よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
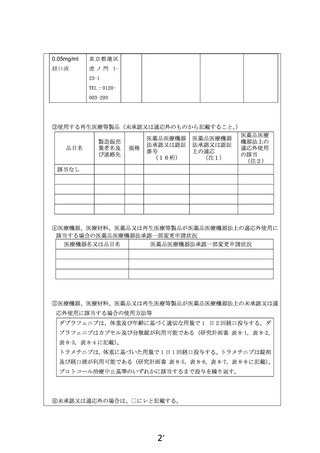
は想定されておりません。多施設で実施する場合には、契約や療養環境の整備、研究体制の構築に時
間を要することから、希望される患者に迅速に当該医療技術を提供できない可能性があります。
現時点で単施設での実施計画となっていますが、多施設での実施の可能性を排除してはおりませ
ん。しかし、研究実施体制等の整備や研究実施費用等の調整が進めることが必要となります。当該薬剤
の適応拡大や安全性に係る情報、さらには患者希望などについて継続的に情報収集し、必要に応じて
他の臨床研究中核病院での実施を想定した計画変更を行いたいと思います。
10. アセント文書内の項「4.」での効果と副作用の説明箇所ですが、例えば中学生用のものでは、
「<効果>腫瘍を小さくして、症状が良くなるかもしれません。」とのみ記載されています。この記載で
は、「「あなた」自身に、こうした一般に期待された効果が出ない場合もあり得る」ことの説明が欠けて
いますので、他の文書においても同様に、それぞれの年齢に応じた表現にて、このように、「あなた」
への効果不発揮の可能性が常にあることの記載を追加すべきでしょう(なお、成人用文書ではほぼ
それに相当する説明はされています)。
【回答】
アセント文書に、一般に期待された効果がでない場合があることを、それぞれの年齢に応じた表現
で、追記しました。また、16 歳~成人用と、代諾者用の説明同意文書の 6.1.の記載を整備しました。
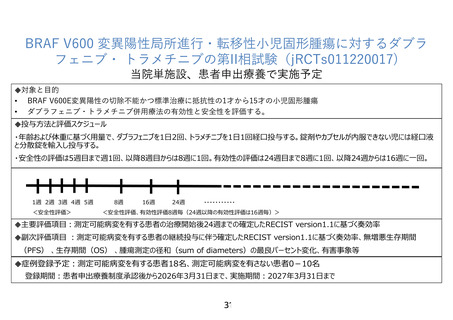
11. いわゆる統計的な仮説を定めた第 II 相試験デザインで行う必要があるのか。しかも、すべての
患者の投与が終了するまで試験が続くとなると、この試験の終了時期は予想できません。
【回答】
製販企業に問い合わせを行い、本研究薬による治験は、BRAF V600 変異陽性脳腫瘍を有する小児
患者に対する国際共同治験(NCT02684058)の登録が終了している他は、新な治験や拡大治験を実施
する予定がないとの回答でした。固形腫瘍を含めた試験はなく、統計学的な仮説を定めた本試験で有効
な結果が得られた場合には、製販企業と相談し、固形腫瘍全般を含めた企業治験または医師主導治験
の実施について検討を進めていきます。本制度では保険収載に向けた実施計画が求められることから、
科学的に有効性を推定できる研究計画としています。当該薬剤の研究開発状況に応じて、「医療上の必
要性が高い未承認薬・適応外薬検討会議」への提案も検討し、固形腫瘍全般への適応拡大・保険適用
へ繋げることを目指します
本研究薬は、FDA では 6 才以上の固形腫瘍全般に承認されていますが、小児がんは症例数が少なく
drug lag が続く可能性が懸念されます。数例の症例報告で終わらせるのではなく、できるだけ統計学的
な評価が可能な枠組みで治療を行ない、患者申出療養の目的の一つである、将来的に保険適用につな
げるためのデータを集積したいと考えております。
この試験の臨床試験は、2027 年 3 月 31 日まで実施されます(登録期間:2026 年 3 月 31 日まで)。
指摘事項 7 とも関連して、本研究の主要評価項目を「測定可能病変を有する研究対象者の治療開始後
24 週までの RECIST version 1.1 に基づく確定した奏効率」に変更しました。このため、最終登録症例の
9
15
間を要することから、希望される患者に迅速に当該医療技術を提供できない可能性があります。
現時点で単施設での実施計画となっていますが、多施設での実施の可能性を排除してはおりませ
ん。しかし、研究実施体制等の整備や研究実施費用等の調整が進めることが必要となります。当該薬剤
の適応拡大や安全性に係る情報、さらには患者希望などについて継続的に情報収集し、必要に応じて
他の臨床研究中核病院での実施を想定した計画変更を行いたいと思います。
10. アセント文書内の項「4.」での効果と副作用の説明箇所ですが、例えば中学生用のものでは、
「<効果>腫瘍を小さくして、症状が良くなるかもしれません。」とのみ記載されています。この記載で
は、「「あなた」自身に、こうした一般に期待された効果が出ない場合もあり得る」ことの説明が欠けて
いますので、他の文書においても同様に、それぞれの年齢に応じた表現にて、このように、「あなた」
への効果不発揮の可能性が常にあることの記載を追加すべきでしょう(なお、成人用文書ではほぼ
それに相当する説明はされています)。
【回答】
アセント文書に、一般に期待された効果がでない場合があることを、それぞれの年齢に応じた表現
で、追記しました。また、16 歳~成人用と、代諾者用の説明同意文書の 6.1.の記載を整備しました。
11. いわゆる統計的な仮説を定めた第 II 相試験デザインで行う必要があるのか。しかも、すべての
患者の投与が終了するまで試験が続くとなると、この試験の終了時期は予想できません。
【回答】
製販企業に問い合わせを行い、本研究薬による治験は、BRAF V600 変異陽性脳腫瘍を有する小児
患者に対する国際共同治験(NCT02684058)の登録が終了している他は、新な治験や拡大治験を実施
する予定がないとの回答でした。固形腫瘍を含めた試験はなく、統計学的な仮説を定めた本試験で有効
な結果が得られた場合には、製販企業と相談し、固形腫瘍全般を含めた企業治験または医師主導治験
の実施について検討を進めていきます。本制度では保険収載に向けた実施計画が求められることから、
科学的に有効性を推定できる研究計画としています。当該薬剤の研究開発状況に応じて、「医療上の必
要性が高い未承認薬・適応外薬検討会議」への提案も検討し、固形腫瘍全般への適応拡大・保険適用
へ繋げることを目指します
本研究薬は、FDA では 6 才以上の固形腫瘍全般に承認されていますが、小児がんは症例数が少なく
drug lag が続く可能性が懸念されます。数例の症例報告で終わらせるのではなく、できるだけ統計学的
な評価が可能な枠組みで治療を行ない、患者申出療養の目的の一つである、将来的に保険適用につな
げるためのデータを集積したいと考えております。
この試験の臨床試験は、2027 年 3 月 31 日まで実施されます(登録期間:2026 年 3 月 31 日まで)。
指摘事項 7 とも関連して、本研究の主要評価項目を「測定可能病変を有する研究対象者の治療開始後
24 週までの RECIST version 1.1 に基づく確定した奏効率」に変更しました。このため、最終登録症例の
9
15