よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
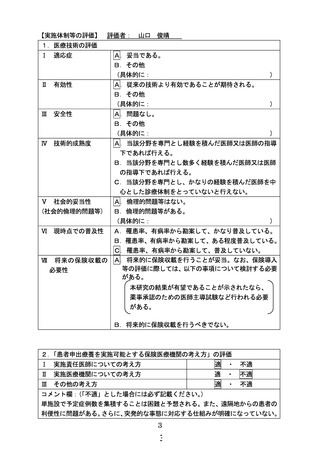
6. 3年強の症例登録期間内に目標症例数(18 例+α)が登録可能であるという根拠を教えてくださ
い。
【回答】
2019 年 8 月から 2022 年 11 月までにがん遺伝子パネル検査を施行され、がんゲノム情報管理センタ
ーに登録された 1 才から 15 才の患者は 807 例で、その中 BRAF V600E 変異陽性の固形腫瘍は 24 例
(中枢神経腫瘍 21 例、その他の固形腫瘍 3 例)に認められております。検査を実施された患者は、基本
的に切除不能で、標準治療がなく、本試験の対象となる患者と考えられます。がん遺伝子パネル検査実
施数は小児を含め増加傾向であり、本試験の対象となる患者は、今後年間 10 名程度発生すると予想し
ています。すでに、現時点で全国より数名の患者が申し出ています。被験者の安全性を確保する十分な
情報伝達体制を確保するため、単施設で施行することとしましたが、全国の申し出られた患者を組み入
れて実施する予定ですので、登録可能であると考えました。
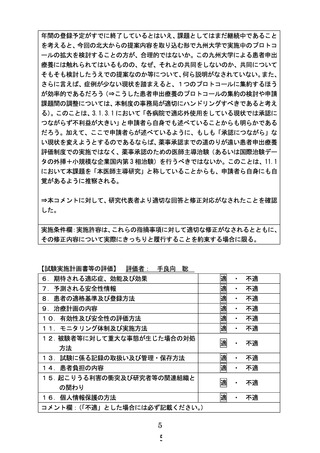
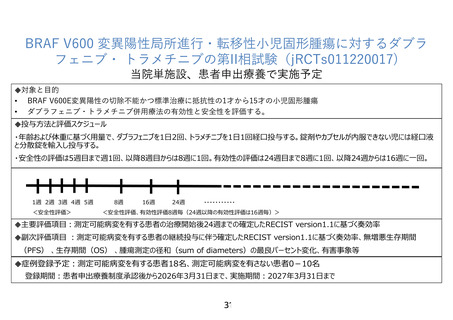
7. 主要評価項目(腫瘍縮小効果)の主たる評価時期について、研究計画書に規定しておく必要はな
いでしょうか。
【回答】
主要評価項目(腫瘍縮小効果)の主たる評価時期については、研究計画書で以下のように規定して
おります。
24.1.2.5 腫瘍の再評価の頻度
本研究の腫瘍評価は,研究対象者研究対象者が研究を継続している間は PD,同意の撤回,死亡,
又は追跡不能のいずれかが認められるまで 24 週までは 8 週毎、以降は 12 週毎に実施する。
この評価時期は、13.1 研究スケジュールの表 13-1 に反映しております。
PD,同意の撤回、死亡、または追跡不能のいずれかが認められるまで評価を継続しますので、
RECIST v1.1 に基づく腫瘍縮小効果に加え、副次評価項目の PFS も正確に評価できる設定でした。
一方、本試験の主要評価項目は「測定可能病変を有する研究対象者の RECIST version 1.1 に基づく
確定した奏効率」としていましたが、多くの症例で治療開始後 24 週までに確定した最良総合効果が評
価可能と考えられます。このため、本試験の主要評価項目を「測定可能病変を有する研究対象者の治
療開始後 24 週までの RECIST version 1.1 に基づく確定した奏効率」に変更し、「測定可能病変を有する
研究対象者の継続投与に伴う RECIST version 1.1 に基づく確定した奏効率」は副次評価項目としました
(研究計画書 11.1 と 11.2.1 を修正)。
このため、最終登録症例の 24 週後の腫瘍評価日を data cut-off date としてデータ固定を行い、この
固定データを用いて中間解析を実施することといたします。試験実施期間終了時に、再度データ固定を
行い、最終解析を行います。この内容を研究計画書 14.4 に追記しました。中間解析は 2026 年 10 月
頃、最終解析は 2027 年 3 月頃に実施できると予想しております。
7
13
い。
【回答】
2019 年 8 月から 2022 年 11 月までにがん遺伝子パネル検査を施行され、がんゲノム情報管理センタ
ーに登録された 1 才から 15 才の患者は 807 例で、その中 BRAF V600E 変異陽性の固形腫瘍は 24 例
(中枢神経腫瘍 21 例、その他の固形腫瘍 3 例)に認められております。検査を実施された患者は、基本
的に切除不能で、標準治療がなく、本試験の対象となる患者と考えられます。がん遺伝子パネル検査実
施数は小児を含め増加傾向であり、本試験の対象となる患者は、今後年間 10 名程度発生すると予想し
ています。すでに、現時点で全国より数名の患者が申し出ています。被験者の安全性を確保する十分な
情報伝達体制を確保するため、単施設で施行することとしましたが、全国の申し出られた患者を組み入
れて実施する予定ですので、登録可能であると考えました。
7. 主要評価項目(腫瘍縮小効果)の主たる評価時期について、研究計画書に規定しておく必要はな
いでしょうか。
【回答】
主要評価項目(腫瘍縮小効果)の主たる評価時期については、研究計画書で以下のように規定して
おります。
24.1.2.5 腫瘍の再評価の頻度
本研究の腫瘍評価は,研究対象者研究対象者が研究を継続している間は PD,同意の撤回,死亡,
又は追跡不能のいずれかが認められるまで 24 週までは 8 週毎、以降は 12 週毎に実施する。
この評価時期は、13.1 研究スケジュールの表 13-1 に反映しております。
PD,同意の撤回、死亡、または追跡不能のいずれかが認められるまで評価を継続しますので、
RECIST v1.1 に基づく腫瘍縮小効果に加え、副次評価項目の PFS も正確に評価できる設定でした。
一方、本試験の主要評価項目は「測定可能病変を有する研究対象者の RECIST version 1.1 に基づく
確定した奏効率」としていましたが、多くの症例で治療開始後 24 週までに確定した最良総合効果が評
価可能と考えられます。このため、本試験の主要評価項目を「測定可能病変を有する研究対象者の治
療開始後 24 週までの RECIST version 1.1 に基づく確定した奏効率」に変更し、「測定可能病変を有する
研究対象者の継続投与に伴う RECIST version 1.1 に基づく確定した奏効率」は副次評価項目としました
(研究計画書 11.1 と 11.2.1 を修正)。
このため、最終登録症例の 24 週後の腫瘍評価日を data cut-off date としてデータ固定を行い、この
固定データを用いて中間解析を実施することといたします。試験実施期間終了時に、再度データ固定を
行い、最終解析を行います。この内容を研究計画書 14.4 に追記しました。中間解析は 2026 年 10 月
頃、最終解析は 2027 年 3 月頃に実施できると予想しております。
7
13