よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(効果)
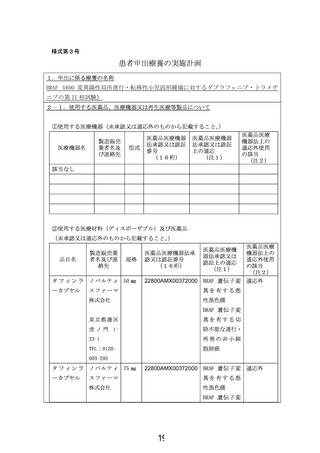
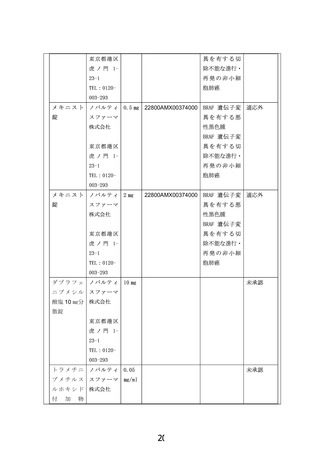
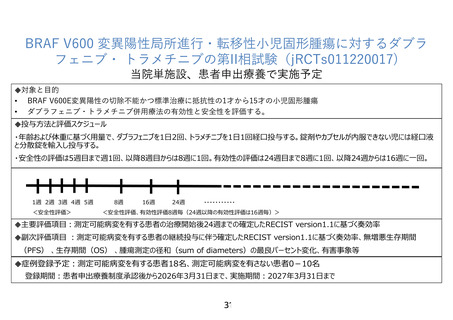
ダブラフェニブ・トラメチニブ併用療法は、BRAFV600 変異を有する切除不能または
転移性悪性黒色腫、および、BRAFV600 変異を有する非小細胞肺癌に対して我が国で承
認されている。FDA ではこれらの承認に加え、2022 年 6 月に、6 歳以上の BRAF V600E
陽性の固形腫瘍に対するダブラフェニブ・トラメチニブ併用療法の適応拡大を行った。
この適応拡大は、成人対象の BRAF V600E 変異陽性の固形腫瘍に対する第 II 相バスケ
ット試験である BRF117019 試験(NCT02034110)と NCI-MATCH 試験(NCT2465060) (Arm H)、
および小児対象の BRAF V600 変異陽性の固形腫瘍に対する第 I/II 相試験である X2101
試験(NCT02124772)の結果に基づいて行われた。
小児対象の X2101 試験に含まれる患者の中で、同併用療法を行った 36 例の LGG を有
する患者における奏効率が報告され、25%(95%CI、12.1~42.2)であった。
医 療 技 術
の
(
概
続
成人対象の上記 2 試験における BRAF V600E 陽性固形腫瘍に対する同併用療法の奏効
要 率は、胆道癌(n = 48)46%、高悪性度神経膠腫(HGG)(n = 48)33%、LGG (n = 14) 50%、
き
)
低悪性度漿液性卵巣癌(n = 5) 80%、小腸癌(n = 4) 50%など、種々のがん種で良好な
結果が報告された。また、小児の BRAFV600 変異を有する Wilms 腫瘍や思春期・若年成
人の膵腺房細胞癌に対してダブラフェニブ・トラメチニブ併用療法が有効であったとす
る症例報告がある。
以上より、小児患者においても、神経膠腫を含む BRAF V600E 変異陽性の固形腫瘍に
対する同併用療法の効果が期待される。
(患者申出療養に係る費用)
患者申出療養にかかる費用として、医師・看護師・薬剤師の人件費 57,923 円
臨床研究支援等支援部門 554,033 円 1症例につき 合計 611,956 円が必要
本研究で用いる試験薬のコストは供給元であるノバルティスファーマ株式会社が無
償提供する。
2
2
ダブラフェニブ・トラメチニブ併用療法は、BRAFV600 変異を有する切除不能または
転移性悪性黒色腫、および、BRAFV600 変異を有する非小細胞肺癌に対して我が国で承
認されている。FDA ではこれらの承認に加え、2022 年 6 月に、6 歳以上の BRAF V600E
陽性の固形腫瘍に対するダブラフェニブ・トラメチニブ併用療法の適応拡大を行った。
この適応拡大は、成人対象の BRAF V600E 変異陽性の固形腫瘍に対する第 II 相バスケ
ット試験である BRF117019 試験(NCT02034110)と NCI-MATCH 試験(NCT2465060) (Arm H)、
および小児対象の BRAF V600 変異陽性の固形腫瘍に対する第 I/II 相試験である X2101
試験(NCT02124772)の結果に基づいて行われた。
小児対象の X2101 試験に含まれる患者の中で、同併用療法を行った 36 例の LGG を有
する患者における奏効率が報告され、25%(95%CI、12.1~42.2)であった。
医 療 技 術
の
(
概
続
成人対象の上記 2 試験における BRAF V600E 陽性固形腫瘍に対する同併用療法の奏効
要 率は、胆道癌(n = 48)46%、高悪性度神経膠腫(HGG)(n = 48)33%、LGG (n = 14) 50%、
き
)
低悪性度漿液性卵巣癌(n = 5) 80%、小腸癌(n = 4) 50%など、種々のがん種で良好な
結果が報告された。また、小児の BRAFV600 変異を有する Wilms 腫瘍や思春期・若年成
人の膵腺房細胞癌に対してダブラフェニブ・トラメチニブ併用療法が有効であったとす
る症例報告がある。
以上より、小児患者においても、神経膠腫を含む BRAF V600E 変異陽性の固形腫瘍に
対する同併用療法の効果が期待される。
(患者申出療養に係る費用)
患者申出療養にかかる費用として、医師・看護師・薬剤師の人件費 57,923 円
臨床研究支援等支援部門 554,033 円 1症例につき 合計 611,956 円が必要
本研究で用いる試験薬のコストは供給元であるノバルティスファーマ株式会社が無
償提供する。
2
2