よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
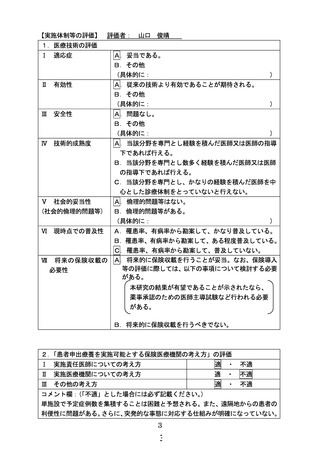
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された
適応の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況
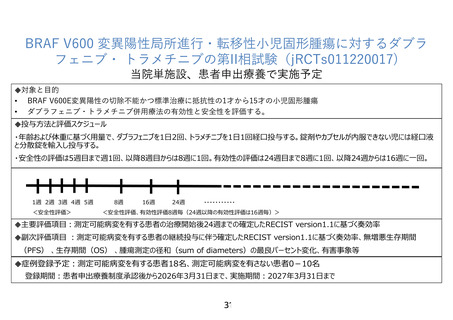
効能・効果(ダブラフェニブとトラメチニブの併用として)
・BRAFV600E/K 変異を有する切除不能または転移性悪性黒色腫
・BRAFV600E/K 変異を有するリンパ節転移のある悪性黒色腫への術後治療
・BRAFV600E 変異を有する転移性非小細胞肺癌
・BRAFV600E 変異を有する局所進行または転移性未分化甲状腺癌
・6 才以上の BRAF V600E 変異陽性の切除不能・転移性固形腫瘍
承認年月(ダブラフェニブとトラメチニブの併用として)
2014 年 1 月
6 才以上の BRAF V600E 変異陽性の切除不能・転移性固形腫瘍に対しては、2022 年 6 月に適応
拡大
欧州での薬事承認の状況
効能・効果(ダブラフェニブとトラメチニブの併用として)
・BRAFV600 変異を有する切除不能または転移性悪性黒色腫
・BRAFV600 変異を有する III 期悪性黒色腫への術後治療
・BRAFV600 変異を有する非小細胞肺癌承認年月(2 剤併用として)
承認年月(ダブラフェニブとトラメチニブの併用として)
2015 年 9 月
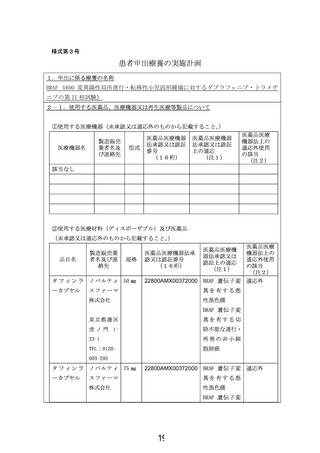
2-3.使用する医薬品、医療機器又は再生医療等製品の入手方法及び管理方法
他者からの提供の有無:
(
有
・ 無 )
(有の場合)提供者名及び連絡先:
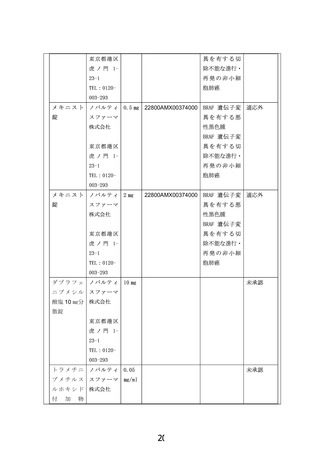
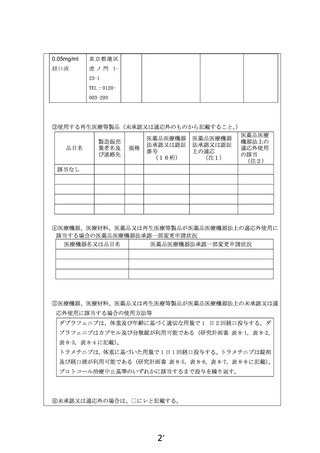
提供者名及び連絡先:郵便番号 105-0001 東京都 港区虎ノ門 1-23-1
ノバルティスファーマ株式会社
入手及び管理方法の詳細:
研究薬は、ノバルティスファーマ株式会社より無償提供を受ける。研究薬は、実施医療機関
にて指名された担当者が受領し、安全かつ適切に取り扱い、研究薬管理者若しくは指名され
22
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された
適応の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況
効能・効果(ダブラフェニブとトラメチニブの併用として)
・BRAFV600E/K 変異を有する切除不能または転移性悪性黒色腫
・BRAFV600E/K 変異を有するリンパ節転移のある悪性黒色腫への術後治療
・BRAFV600E 変異を有する転移性非小細胞肺癌
・BRAFV600E 変異を有する局所進行または転移性未分化甲状腺癌
・6 才以上の BRAF V600E 変異陽性の切除不能・転移性固形腫瘍
承認年月(ダブラフェニブとトラメチニブの併用として)
2014 年 1 月
6 才以上の BRAF V600E 変異陽性の切除不能・転移性固形腫瘍に対しては、2022 年 6 月に適応
拡大
欧州での薬事承認の状況
効能・効果(ダブラフェニブとトラメチニブの併用として)
・BRAFV600 変異を有する切除不能または転移性悪性黒色腫
・BRAFV600 変異を有する III 期悪性黒色腫への術後治療
・BRAFV600 変異を有する非小細胞肺癌承認年月(2 剤併用として)
承認年月(ダブラフェニブとトラメチニブの併用として)
2015 年 9 月
2-3.使用する医薬品、医療機器又は再生医療等製品の入手方法及び管理方法
他者からの提供の有無:
(
有
・ 無 )
(有の場合)提供者名及び連絡先:
提供者名及び連絡先:郵便番号 105-0001 東京都 港区虎ノ門 1-23-1
ノバルティスファーマ株式会社
入手及び管理方法の詳細:
研究薬は、ノバルティスファーマ株式会社より無償提供を受ける。研究薬は、実施医療機関
にて指名された担当者が受領し、安全かつ適切に取り扱い、研究薬管理者若しくは指名され
22