よむ、つかう、まなぶ。
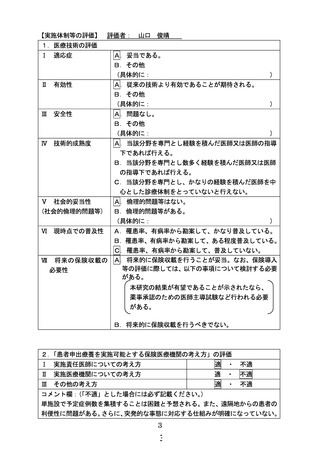
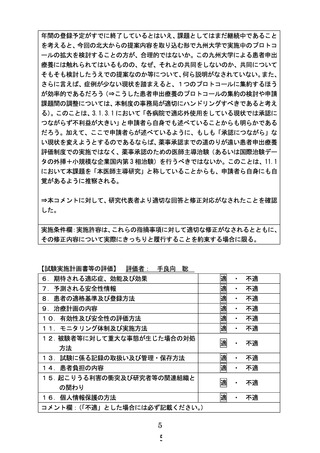
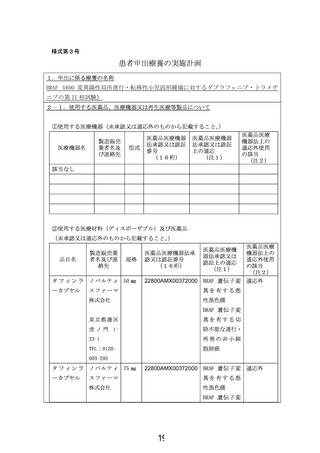
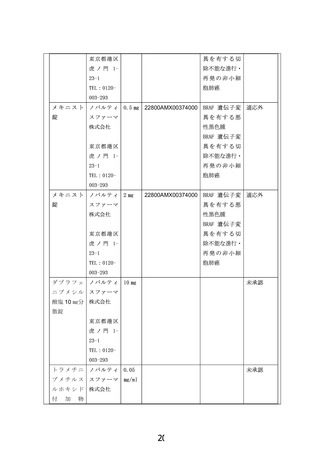
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
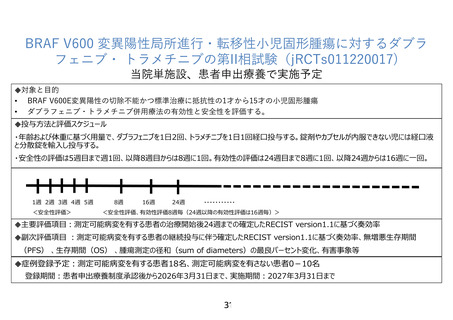
7-2.予定の試験期間及び症例数
予定登録期間:承認後から 2026 年 3 月 31 日まで
予定試験期間:承認後から 2027 年 3 月 31 日まで
予定症例数:測定可能病変を有する研究対象者 18 名、測定可能病変を有さない研究対象者 010 名
既に実績のある症例数:日本を含め小児を対象に治験が行われている。2021 年 12 月より九
州大学小児科にて BRAF V600E 陽性小児脳腫瘍を対象に患者申出療養を利用した臨床研究が
行われ、4 例の登録が終了している。
予定試験期間及び予定症例数の設定根拠:
臓器横断的に研究対象者が組入れられる本研究では、測定可能病変を有する研究対象者全体
で40%の奏効割合が得られれば、十分な臨床的意義があると考え、期待奏効率は40%とし
た。
一方、本研究の対象は、局所進行性、再発性または転移性の標準治療の無い固形腫瘍であ
り、このような対象集団における殺細胞性抗がん薬の奏効割合はがん種によらず10-20%程
度と報告されている。また、BRAF V600変異を伴う低悪性度神経膠腫に対する化学療法の
ORR(PR+CR)は11%であった。以上より、本研究における閾値奏効率を10%とした。
目標症例数の設定は、二項分布に基づく正確な方法による仮説検定を用いる。期待奏効率
40%、閾値奏効率 10% 、有意水準片側 5%で、研究対象者登録の実施可能性を考慮し、測定
可能病変のある研究対象者の目標登録数を 18 例(検出力 91%)とした。
有効性の探索的な検討も困難なまま多数の患者に投与を拡大することは倫理的に望ましくな
いと考えるため,測定可能病変を有さない研究対象者は 10 例を目安とする。この 10 例を登
録した時点で測定可能病変を有する研究対象者が 18 例未満の場合は,測定可能病変を有す
る研究対象者のみ登録を継続する。逆に,測定可能病変を有する研究対象者が 18 例登録され
た時点で,測定可能病変を有さない研究対象者の登録は終了する。
8.モニタリング体制及び実施方法
本研究のモニタリングは、業務受託機関へモニタリング業務を委託し、別途定める「モニタ
リング手順書」に従ってモニタリングを実施する。また、研究責任医師及び実施医療機関は、
モニタリング担当者の求めに応じ、研究対象者のすべての研究関連記録を直接閲覧に供しな
ければならない。モニタリング担当者は、本研究が臨床研究法、関連通知及び本研究計画書
を遵守して実施されていることを確認する。
モニタリング責任者:北海道大学病院 がん遺伝子診断部 相馬禎子
26
予定登録期間:承認後から 2026 年 3 月 31 日まで
予定試験期間:承認後から 2027 年 3 月 31 日まで
予定症例数:測定可能病変を有する研究対象者 18 名、測定可能病変を有さない研究対象者 010 名
既に実績のある症例数:日本を含め小児を対象に治験が行われている。2021 年 12 月より九
州大学小児科にて BRAF V600E 陽性小児脳腫瘍を対象に患者申出療養を利用した臨床研究が
行われ、4 例の登録が終了している。
予定試験期間及び予定症例数の設定根拠:
臓器横断的に研究対象者が組入れられる本研究では、測定可能病変を有する研究対象者全体
で40%の奏効割合が得られれば、十分な臨床的意義があると考え、期待奏効率は40%とし
た。
一方、本研究の対象は、局所進行性、再発性または転移性の標準治療の無い固形腫瘍であ
り、このような対象集団における殺細胞性抗がん薬の奏効割合はがん種によらず10-20%程
度と報告されている。また、BRAF V600変異を伴う低悪性度神経膠腫に対する化学療法の
ORR(PR+CR)は11%であった。以上より、本研究における閾値奏効率を10%とした。
目標症例数の設定は、二項分布に基づく正確な方法による仮説検定を用いる。期待奏効率
40%、閾値奏効率 10% 、有意水準片側 5%で、研究対象者登録の実施可能性を考慮し、測定
可能病変のある研究対象者の目標登録数を 18 例(検出力 91%)とした。
有効性の探索的な検討も困難なまま多数の患者に投与を拡大することは倫理的に望ましくな
いと考えるため,測定可能病変を有さない研究対象者は 10 例を目安とする。この 10 例を登
録した時点で測定可能病変を有する研究対象者が 18 例未満の場合は,測定可能病変を有す
る研究対象者のみ登録を継続する。逆に,測定可能病変を有する研究対象者が 18 例登録され
た時点で,測定可能病変を有さない研究対象者の登録は終了する。
8.モニタリング体制及び実施方法
本研究のモニタリングは、業務受託機関へモニタリング業務を委託し、別途定める「モニタ
リング手順書」に従ってモニタリングを実施する。また、研究責任医師及び実施医療機関は、
モニタリング担当者の求めに応じ、研究対象者のすべての研究関連記録を直接閲覧に供しな
ければならない。モニタリング担当者は、本研究が臨床研究法、関連通知及び本研究計画書
を遵守して実施されていることを確認する。
モニタリング責任者:北海道大学病院 がん遺伝子診断部 相馬禎子
26