よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (29 ページ)
出典
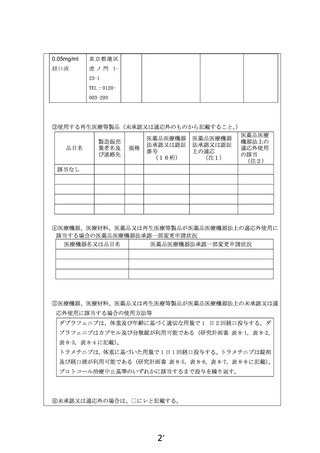
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
CI、1.9~45.4)
、ダブラフェニブ・トラメチニブ併用療法(36 例)で 25%(95%CI、12.1
~42.2)であった。
併用療法において、最も頻度の高い治療関連有害事象は発熱(18 例、50%)と皮膚乾燥(15
例、42%)であった。有害事象による治療中止は 8 例(22%)に認めた。治療関連の Grade
3 以上の有害事象を 14 例(39%)、重篤な有害事象を 8 例(22%)に認めたが、死亡に至る
有害事象は認めなかった。
その他、小児のBRAFV600変異を有するWilms腫瘍や小児および思春期・若年成人の膵腺房細胞
癌に対してダブラフェニブ・トラメチニブ併用療法が有効であったとする症例報告がある
7)8)9)
。
16.社会的妥当性(社会的倫理的問題等)
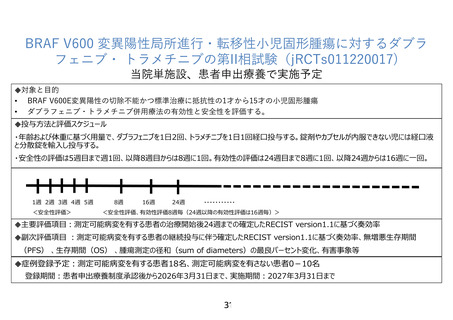
標準治療のない、または治療抵抗性の局所進行性・転移性小児固形腫瘍においては治療戦略
が確立していない。治療対象となりうる遺伝子変異が検出された症例でも、対象が小児であ
ることや疾患の希少性から治験や臨床研究が行われ難く、分子標的薬に到達することが困難
である。米国では、6 歳以上の BRAF V600E 陽性の固形腫瘍に対して、ダブラフェニブ・ト
ラメチニブ併用療法が承認(適応拡大)されたが、国内では未承認であり、現在該当する小
児患者が組み入れ可能な治験は実施されていない。本試験では、BRAF V600 変異陽性の固
形腫瘍を有する小児患者を対象に、ダブラフェニブ・トラメチニブの有効性と安全性を確認
する。当該研究結果を研究薬提供企業であるノバルティスファーマ株式会社と共有し、有効
性が確認された場合には、当該企業による治験の実施を含め薬事承認申請までの道筋を検討
する。
17.現時点での普及性
ダブラフェニブとトラメチニブは PMDA では BRAF 変異を有する悪性黒色腫と、BRAF 変異を有
する切除不能な進行・再発の非小細胞肺癌でのみ承認されているが、FDA では 2022 年 6 月
に、6 歳以上の BRAF V600E 変異を有する固形腫瘍に適応拡大された。
18.将来の保険収載の必要性
ダブラフェニブ・トラメチニブ併用療法は、国際共同治験(NCT0212477、 NCT2465060、
NCT2124772)によって、小児を含む BRAF V600E 変異を有する切除不能・転移性固形腫瘍にお
ける有効性と安全性が確認され、6 歳以上の固形腫瘍に適応拡大され、今後 12 か月以上の小
児に適応拡大される可能性がある。一方、国内では小児に対する適応はなく、将来の保険収
載が必要である。
19.文献情報
・患者申出療養の内容を論述した論文
(実施結果の分析について言及しているものであること)
1)Prescribing information of Tafinlar (dabrafenib).
https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/202806s022lbl.pdf
29
、ダブラフェニブ・トラメチニブ併用療法(36 例)で 25%(95%CI、12.1
~42.2)であった。
併用療法において、最も頻度の高い治療関連有害事象は発熱(18 例、50%)と皮膚乾燥(15
例、42%)であった。有害事象による治療中止は 8 例(22%)に認めた。治療関連の Grade
3 以上の有害事象を 14 例(39%)、重篤な有害事象を 8 例(22%)に認めたが、死亡に至る
有害事象は認めなかった。
その他、小児のBRAFV600変異を有するWilms腫瘍や小児および思春期・若年成人の膵腺房細胞
癌に対してダブラフェニブ・トラメチニブ併用療法が有効であったとする症例報告がある
7)8)9)
。
16.社会的妥当性(社会的倫理的問題等)
標準治療のない、または治療抵抗性の局所進行性・転移性小児固形腫瘍においては治療戦略
が確立していない。治療対象となりうる遺伝子変異が検出された症例でも、対象が小児であ
ることや疾患の希少性から治験や臨床研究が行われ難く、分子標的薬に到達することが困難
である。米国では、6 歳以上の BRAF V600E 陽性の固形腫瘍に対して、ダブラフェニブ・ト
ラメチニブ併用療法が承認(適応拡大)されたが、国内では未承認であり、現在該当する小
児患者が組み入れ可能な治験は実施されていない。本試験では、BRAF V600 変異陽性の固
形腫瘍を有する小児患者を対象に、ダブラフェニブ・トラメチニブの有効性と安全性を確認
する。当該研究結果を研究薬提供企業であるノバルティスファーマ株式会社と共有し、有効
性が確認された場合には、当該企業による治験の実施を含め薬事承認申請までの道筋を検討
する。
17.現時点での普及性
ダブラフェニブとトラメチニブは PMDA では BRAF 変異を有する悪性黒色腫と、BRAF 変異を有
する切除不能な進行・再発の非小細胞肺癌でのみ承認されているが、FDA では 2022 年 6 月
に、6 歳以上の BRAF V600E 変異を有する固形腫瘍に適応拡大された。
18.将来の保険収載の必要性
ダブラフェニブ・トラメチニブ併用療法は、国際共同治験(NCT0212477、 NCT2465060、
NCT2124772)によって、小児を含む BRAF V600E 変異を有する切除不能・転移性固形腫瘍にお
ける有効性と安全性が確認され、6 歳以上の固形腫瘍に適応拡大され、今後 12 か月以上の小
児に適応拡大される可能性がある。一方、国内では小児に対する適応はなく、将来の保険収
載が必要である。
19.文献情報
・患者申出療養の内容を論述した論文
(実施結果の分析について言及しているものであること)
1)Prescribing information of Tafinlar (dabrafenib).
https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/202806s022lbl.pdf
29