よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
患者申出療養評価会議事務局からの確認事項に対する回答
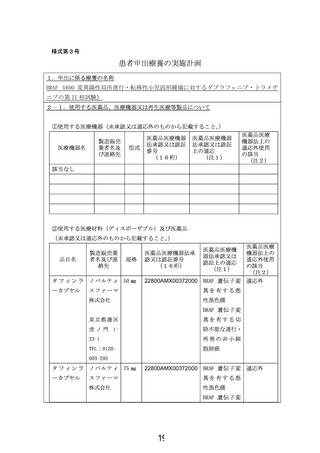
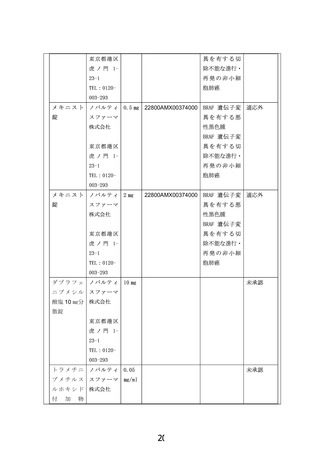
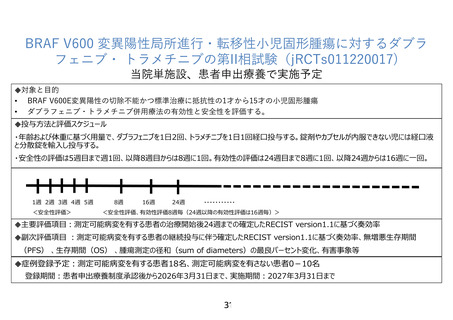
患者申出療養技術名: BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラフェニブ・
トラメチニブの第 II 相試験
令和4年 12 月 17 日
所属・氏名: 北海道大学病院 木下 一郎
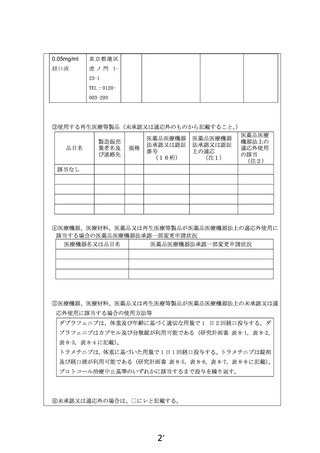
1.治験・拡大治験や先進医療といった他の制度で本技術が実施できない理由について説明してくだ
さい。
【回答】
BRAFV600 変異陽性の低悪性度神経膠腫、若しくは再発又は難治性高悪性度神経膠腫を有する小
児患者を対象としたダブラフェニブ・トラメチニブ併用療法の効果を評価する第 II 相試験が、日本を含む
国際共同企業治験として実施されておりますが、登録期間が終了し、現在は新規患者が参加することが
できません。また、小児患者の脳腫瘍以外の固形腫瘍に対する治験・拡大治験や先進医療は実施され
ておりません。
試験計画開始段階で、製販企業に対して、小児固形腫瘍に対する治験または先進医療制度でのダブ
ラフェニブ・トラメチニブの当該医薬品の薬剤提供を申請しましたが、有償無償に関わらず提供できない
との回答でした。一方、患者申出療養制度で実施される場合は、人道的な見地より、当該医薬品の無償
提供を行うことは可能との回答を頂きました。
現時点においても、計画中の患者申出療養の対象者が参加可能な治験・拡大治験・先進医療は国内
で実施されておらず、製販企業においても実施される予定がないと回答を得ております。
前述の企業治験で有用な結果が得られれば、小児患者の脳腫瘍に対する適応拡大につながると考
えておりますが、当該企業より申請時期については告知できないとの回答があり、また、同治験では脳
腫瘍以外の固形腫瘍は対象となっていませんでした。
一方、FDA では 6 歳以上の小児の BRAF V600E 陽性固形腫瘍に対してダブラフェニブ・トラメチニブ
併用療法の臓器横断的な適応拡大が行われております。国内でも、保険適用済みのがん遺伝子パネ
ル検査で、小児の脳腫瘍およびその他の固形腫瘍において BRAF V600 変異が一定の頻度で見つかっ
ており、他に標準治療がない小児患者と家族の思いに応える形で、患者申出療養制度での本技術の実
施を行いたいと考えております。
1
7
患者申出療養技術名: BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラフェニブ・
トラメチニブの第 II 相試験
令和4年 12 月 17 日
所属・氏名: 北海道大学病院 木下 一郎
1.治験・拡大治験や先進医療といった他の制度で本技術が実施できない理由について説明してくだ
さい。
【回答】
BRAFV600 変異陽性の低悪性度神経膠腫、若しくは再発又は難治性高悪性度神経膠腫を有する小
児患者を対象としたダブラフェニブ・トラメチニブ併用療法の効果を評価する第 II 相試験が、日本を含む
国際共同企業治験として実施されておりますが、登録期間が終了し、現在は新規患者が参加することが
できません。また、小児患者の脳腫瘍以外の固形腫瘍に対する治験・拡大治験や先進医療は実施され
ておりません。
試験計画開始段階で、製販企業に対して、小児固形腫瘍に対する治験または先進医療制度でのダブ
ラフェニブ・トラメチニブの当該医薬品の薬剤提供を申請しましたが、有償無償に関わらず提供できない
との回答でした。一方、患者申出療養制度で実施される場合は、人道的な見地より、当該医薬品の無償
提供を行うことは可能との回答を頂きました。
現時点においても、計画中の患者申出療養の対象者が参加可能な治験・拡大治験・先進医療は国内
で実施されておらず、製販企業においても実施される予定がないと回答を得ております。
前述の企業治験で有用な結果が得られれば、小児患者の脳腫瘍に対する適応拡大につながると考
えておりますが、当該企業より申請時期については告知できないとの回答があり、また、同治験では脳
腫瘍以外の固形腫瘍は対象となっていませんでした。
一方、FDA では 6 歳以上の小児の BRAF V600E 陽性固形腫瘍に対してダブラフェニブ・トラメチニブ
併用療法の臓器横断的な適応拡大が行われております。国内でも、保険適用済みのがん遺伝子パネ
ル検査で、小児の脳腫瘍およびその他の固形腫瘍において BRAF V600 変異が一定の頻度で見つかっ
ており、他に標準治療がない小児患者と家族の思いに応える形で、患者申出療養制度での本技術の実
施を行いたいと考えております。
1
7