よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
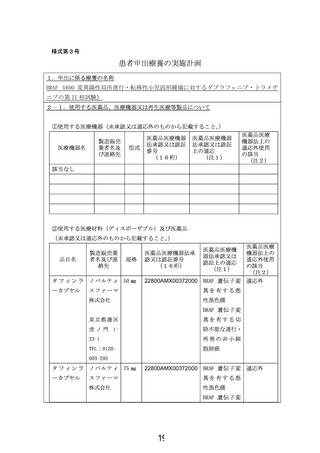
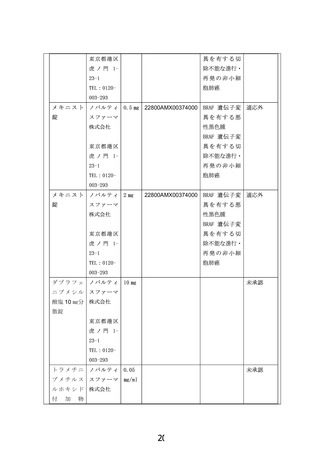
た担当者のみが出入りする安全な場所に保管する。研究薬は、受領後、薬剤ラベル、治験薬
概要書に記載されている指示に従って保管する。ノバルティスファーマ株式会社から実施医
療機関に提供された研究薬は、研究薬管理者が管理する。管理の手順については「研究薬管
理手順書」に従う。実施期間中に研究薬の破損や汚染、その他の不備等により研究薬を使用
しない場合、もしくは、研究薬投与期間の終了後は、研究薬管理表に廃棄するボトル数、製
造番号、使用期限、廃棄の理由、廃棄後の在庫数と共に記録する。廃棄の際は、当院の規定
に従って、医療用廃棄物として廃棄する。
3.期待される適応症、効能及び効果
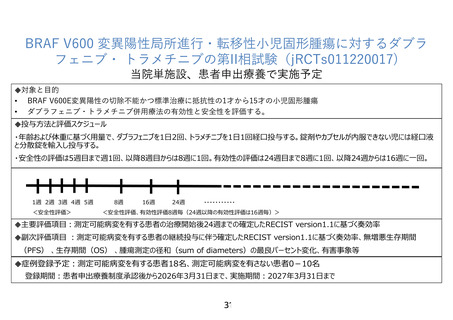
適応症:生後 12 か月以上 15 歳以下の BRAF V600 変異陽性進行・転移性固形腫瘍
効能・効果:腫瘍の縮小、無増悪生存期間・生存期間の延長
4.予測される安全性情報
ダブラフェニブによる重大な副作用として、悪性腫瘍、心機能障害、肝機能障害、静脈血栓
塞栓症、脳血管障害
トラメチニブによる重大な副作用として心機能障害、肝機能障害、間質性肺疾患、横紋筋融
解症、静脈血栓塞栓症、脳血管障害
5.患者の適格基準及び選定方法
選択基準
1) 登録時の年齢が生後12か月以上15 歳以下
2) 組織学診によって小児固形腫瘍と確定診断されている。
3) 我が国で保険適用済みの遺伝子パネル検査の結果、BRAF V600変異陽性と判明してい
る。
4) 切除不能(局所進行または転移性)で、標準治療がない、または標準治療に抵抗性であ
る。
5) ECOGのPerformance status (PS)が 0~2
6) 登録日時点で抗癌医薬品(化学療法、分子標的療法、免疫療法、内分泌療法)の投与や
脳以外の放射線治療を受けておらず、それらに伴う急性毒性が回復していること。
7) 放射線療法の最終照射日から7日以上経過していること。
8) 投与開始前14日以内の最新の検査値が以下のすべてを満たす。
① 好中球数≧1,000/mm3
② ヘグロビン≧8.0 g/dL(登録に用いた検査の採血日前 14日以内に輸血を行ってい
ないこと
③ 血小板数≧7.5×104 / mm3
④ 総ビリルビン≦ULN x 1.5 mg/dL
⑤ ALT(GPT)≦ULN x 3 IU/L
⑥ 血清クレアチニン値が年齢別に以下を満たすもの(5 歳未満:0.8 mg/dl 以下,5
23
概要書に記載されている指示に従って保管する。ノバルティスファーマ株式会社から実施医
療機関に提供された研究薬は、研究薬管理者が管理する。管理の手順については「研究薬管
理手順書」に従う。実施期間中に研究薬の破損や汚染、その他の不備等により研究薬を使用
しない場合、もしくは、研究薬投与期間の終了後は、研究薬管理表に廃棄するボトル数、製
造番号、使用期限、廃棄の理由、廃棄後の在庫数と共に記録する。廃棄の際は、当院の規定
に従って、医療用廃棄物として廃棄する。
3.期待される適応症、効能及び効果
適応症:生後 12 か月以上 15 歳以下の BRAF V600 変異陽性進行・転移性固形腫瘍
効能・効果:腫瘍の縮小、無増悪生存期間・生存期間の延長
4.予測される安全性情報
ダブラフェニブによる重大な副作用として、悪性腫瘍、心機能障害、肝機能障害、静脈血栓
塞栓症、脳血管障害
トラメチニブによる重大な副作用として心機能障害、肝機能障害、間質性肺疾患、横紋筋融
解症、静脈血栓塞栓症、脳血管障害
5.患者の適格基準及び選定方法
選択基準
1) 登録時の年齢が生後12か月以上15 歳以下
2) 組織学診によって小児固形腫瘍と確定診断されている。
3) 我が国で保険適用済みの遺伝子パネル検査の結果、BRAF V600変異陽性と判明してい
る。
4) 切除不能(局所進行または転移性)で、標準治療がない、または標準治療に抵抗性であ
る。
5) ECOGのPerformance status (PS)が 0~2
6) 登録日時点で抗癌医薬品(化学療法、分子標的療法、免疫療法、内分泌療法)の投与や
脳以外の放射線治療を受けておらず、それらに伴う急性毒性が回復していること。
7) 放射線療法の最終照射日から7日以上経過していること。
8) 投与開始前14日以内の最新の検査値が以下のすべてを満たす。
① 好中球数≧1,000/mm3
② ヘグロビン≧8.0 g/dL(登録に用いた検査の採血日前 14日以内に輸血を行ってい
ないこと
③ 血小板数≧7.5×104 / mm3
④ 総ビリルビン≦ULN x 1.5 mg/dL
⑤ ALT(GPT)≦ULN x 3 IU/L
⑥ 血清クレアチニン値が年齢別に以下を満たすもの(5 歳未満:0.8 mg/dl 以下,5
23