よむ、つかう、まなぶ。
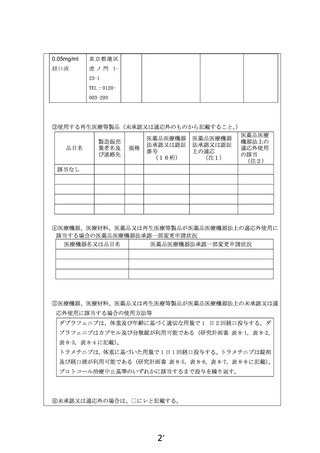
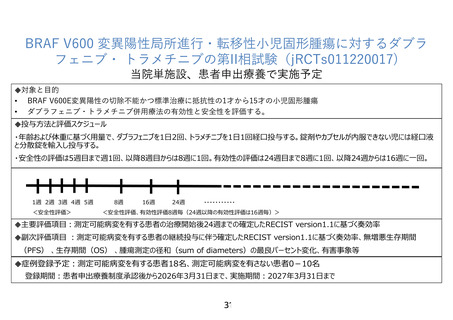
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
24 週後の腫瘍評価日を data cut-off date としてデータ固定を行い、この固定データを用いて中間解析
を実施することといたします。試験実施期間終了時に、再度データ固定を行い、最終解析を行います。
以上の内容を研究計画書 11.1 と 14.4 に追記しました。このため、中間解析は 2026 年 10 月頃、最終解
析は 2027 年 3 月頃に実施できると予想されます。
なお、試験終了時点で投与が継続されている患者に対する追加の薬剤提供について製販企業と相談
しており、薬剤提供が得られた場合は、患者申出療養の延長を検討いたします。
また、ダブラフェニブとトラメチニブの適応拡大がおこなわれた場合、保険適用の対象となった患者に
ついては、保険診療に切り替えて内服を継続する予定です。
12. 研究計画書<10.7 同意撤回時の対応>において、「研究参加の同意撤回があった場合,研究
対象者の代諾者および研究対象者と相談し,同意撤回に係る理由を確認するとともに」と計画され
ていますが、同意撤回に係る理由を確認することは倫理的にご法度とされている行為です。このこと
はヘルシンキ宣言のみならず、生命・医学系指針においても同様です(以下、指針ガイダンス p.120
での言及を引用:『なお、同意の撤回又は拒否の申出に際して理由の提示を求めることは、当該申
出を萎縮させることにつながるおそれがあるため、有害事象の発生が疑われる場合など必要な場合
を除き、適切ではない。』)。したがいまして、この点については研究計画の見直し(同記載の削除)が
必要です。
【回答】
研究計画書 10.7 より該当部分を削除しました。また、同意撤回に係る事項を再考し、代諾者と研究
対象者の意思が異なった場合は研究対象者の意思を優先が優先されることを明記し、同意撤回の内容
を整理・区別し、事後の対応を明記しました。これらの内容を、16 歳から成人用説明同意文書と代諾者
用説明同意文書に反映させました。
以上
10
16
を実施することといたします。試験実施期間終了時に、再度データ固定を行い、最終解析を行います。
以上の内容を研究計画書 11.1 と 14.4 に追記しました。このため、中間解析は 2026 年 10 月頃、最終解
析は 2027 年 3 月頃に実施できると予想されます。
なお、試験終了時点で投与が継続されている患者に対する追加の薬剤提供について製販企業と相談
しており、薬剤提供が得られた場合は、患者申出療養の延長を検討いたします。
また、ダブラフェニブとトラメチニブの適応拡大がおこなわれた場合、保険適用の対象となった患者に
ついては、保険診療に切り替えて内服を継続する予定です。
12. 研究計画書<10.7 同意撤回時の対応>において、「研究参加の同意撤回があった場合,研究
対象者の代諾者および研究対象者と相談し,同意撤回に係る理由を確認するとともに」と計画され
ていますが、同意撤回に係る理由を確認することは倫理的にご法度とされている行為です。このこと
はヘルシンキ宣言のみならず、生命・医学系指針においても同様です(以下、指針ガイダンス p.120
での言及を引用:『なお、同意の撤回又は拒否の申出に際して理由の提示を求めることは、当該申
出を萎縮させることにつながるおそれがあるため、有害事象の発生が疑われる場合など必要な場合
を除き、適切ではない。』)。したがいまして、この点については研究計画の見直し(同記載の削除)が
必要です。
【回答】
研究計画書 10.7 より該当部分を削除しました。また、同意撤回に係る事項を再考し、代諾者と研究
対象者の意思が異なった場合は研究対象者の意思を優先が優先されることを明記し、同意撤回の内容
を整理・区別し、事後の対応を明記しました。これらの内容を、16 歳から成人用説明同意文書と代諾者
用説明同意文書に反映させました。
以上
10
16