よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
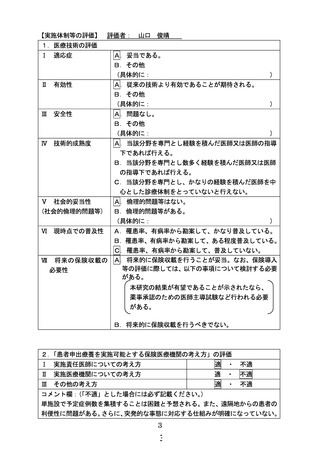
3.2.の後半のコメント部分への回答の中で、「本研究期間中に 16 歳以上に達する小児被験者に対
して、改めてインフォームド・コンセントを取得することについては、説明文書・同意文書の改訂が行
われた場合のみとし、成人用の説明同意書を用いて再同意を取得します」と回答されておられます
が、この回答をそのまま理解すると、研究期間中に被験児が 16 歳に達した場合であっても、文書改
訂が行われない限りは、成人用文書による詳細な説明も、本人のインフォームド・コンセントも改めて
取得することはしない、ということになります。これは、本人意思の尊重という倫理原則に反する扱い
ですので、不適切であると考えます。文書改訂があるか否かに拘わらず、被験児が 16 歳に達した段
階できちんとした本人のインフォームド・コンセントを取得する計画に修正すべきでしょう。
【回答】
16 歳に達した時点で「16 歳から成人用の説明文書・同意書文書」を用いて、再同意を取得することと
し、研究計画書 10.3 に追記しました。また、関連して、10.6, 10.7, 10.8 の 16 歳に達した研究対象者に対
する記載を追記・修正しました。
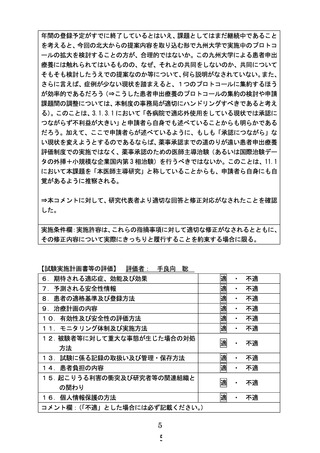
4.今回の申請の発端者が既に死亡している中で、本課題を新たに患者申出療養評価制度の中で申
請する必要性があまりないように思われるだけでなく、本制度本来の趣旨に合致しないように思われ
る。とりわけ、本対象技術については、小児脳腫瘍を対象に九州大学が同じく患者申出療養として実
施する課題があり、そちらでは 4 症例/4 年間の登録予定がすでに終了しているとはいえ、課題とし
てはまだ継続中であることを考えると、今回の北大からの提案内容を取り込む形で九州大学で実施
中のプロトコールの拡大を検討することの方が、合理的ではないか。この九州大学による患者申出
療養には触れられてはいるものの、なぜ、それとの共同をしないのか、共同についてそもそも検討し
たうえでの提案なのか等について、何ら説明がなされていない。また、さらに言えば、症例が少ない
現状を踏まえると、1つのプロトコールに集約するほうが効率的であるだろう。このことは、3.1.3.1 に
おいて「各病院で適応外使用をしている現状では承認につながらず不利益が大きい」と申請者ら自
身でも述べていることからも明らかであるだろう。
【回答】
九州大学の患者申出療養は脳腫瘍 4 例に限定された研究計画及び製販企業との薬剤提供であり、
すでに登録は終了しており、脳腫瘍以外の固形腫瘍患者は参加できません。九州大学に対して症例追
加の見通しについて照会しましたが、追加症例への薬剤提供や試験期間の延長が困難で、症例追加は
行わない旨の回答を頂きました。
研究計画書で「各病院で適応外使用をしている現状では承認につながらず不利益が大きい」と述べて
おりますが、主に診療における適応外使用で治療を行う場合について言及したものであり、有効性及び
安全性を評価する臨床試験として治療を行う必要性を述べております。
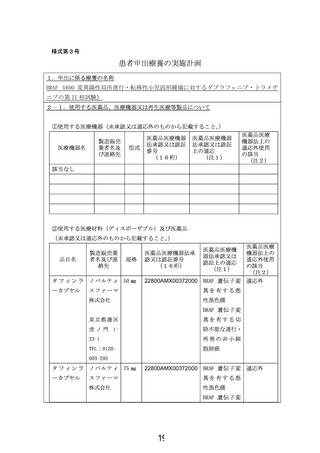
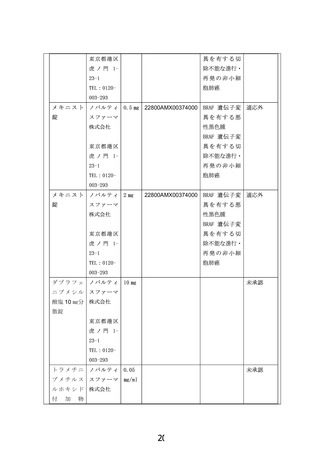
本申請の端緒となったのは膵腺房細胞癌の患児であり、試験の計画を開始した段階で製販企業に対
して、小児固形腫瘍全般に対する治験または先進医療制度でのダブラフェニブ・トラメチニブの当該医薬
5
11
して、改めてインフォームド・コンセントを取得することについては、説明文書・同意文書の改訂が行
われた場合のみとし、成人用の説明同意書を用いて再同意を取得します」と回答されておられます
が、この回答をそのまま理解すると、研究期間中に被験児が 16 歳に達した場合であっても、文書改
訂が行われない限りは、成人用文書による詳細な説明も、本人のインフォームド・コンセントも改めて
取得することはしない、ということになります。これは、本人意思の尊重という倫理原則に反する扱い
ですので、不適切であると考えます。文書改訂があるか否かに拘わらず、被験児が 16 歳に達した段
階できちんとした本人のインフォームド・コンセントを取得する計画に修正すべきでしょう。
【回答】
16 歳に達した時点で「16 歳から成人用の説明文書・同意書文書」を用いて、再同意を取得することと
し、研究計画書 10.3 に追記しました。また、関連して、10.6, 10.7, 10.8 の 16 歳に達した研究対象者に対
する記載を追記・修正しました。
4.今回の申請の発端者が既に死亡している中で、本課題を新たに患者申出療養評価制度の中で申
請する必要性があまりないように思われるだけでなく、本制度本来の趣旨に合致しないように思われ
る。とりわけ、本対象技術については、小児脳腫瘍を対象に九州大学が同じく患者申出療養として実
施する課題があり、そちらでは 4 症例/4 年間の登録予定がすでに終了しているとはいえ、課題とし
てはまだ継続中であることを考えると、今回の北大からの提案内容を取り込む形で九州大学で実施
中のプロトコールの拡大を検討することの方が、合理的ではないか。この九州大学による患者申出
療養には触れられてはいるものの、なぜ、それとの共同をしないのか、共同についてそもそも検討し
たうえでの提案なのか等について、何ら説明がなされていない。また、さらに言えば、症例が少ない
現状を踏まえると、1つのプロトコールに集約するほうが効率的であるだろう。このことは、3.1.3.1 に
おいて「各病院で適応外使用をしている現状では承認につながらず不利益が大きい」と申請者ら自
身でも述べていることからも明らかであるだろう。
【回答】
九州大学の患者申出療養は脳腫瘍 4 例に限定された研究計画及び製販企業との薬剤提供であり、
すでに登録は終了しており、脳腫瘍以外の固形腫瘍患者は参加できません。九州大学に対して症例追
加の見通しについて照会しましたが、追加症例への薬剤提供や試験期間の延長が困難で、症例追加は
行わない旨の回答を頂きました。
研究計画書で「各病院で適応外使用をしている現状では承認につながらず不利益が大きい」と述べて
おりますが、主に診療における適応外使用で治療を行う場合について言及したものであり、有効性及び
安全性を評価する臨床試験として治療を行う必要性を述べております。
本申請の端緒となったのは膵腺房細胞癌の患児であり、試験の計画を開始した段階で製販企業に対
して、小児固形腫瘍全般に対する治験または先進医療制度でのダブラフェニブ・トラメチニブの当該医薬
5
11