よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ている
10. 登録前 3 ヶ月以内にうっ血性心不全の既往歴がある、またはうっ血性心不全を合併
している。
11. RAS の活性化変異が確認された悪性腫瘍又は BRAF-KIAA1549 などの BRAF 融合を伴う
悪性腫瘍の既往がある。
12. B 型肝炎ウイルス又は C 型肝炎ウイルス感染の既往を有する。
13. 網膜静脈閉塞症(RVO)又は中心性漿液性脈絡網膜症の既往を有するか現時点でこれ
らの所見が認められる
14. 研究責任医師あるいは研究分担医師が不適格と考える
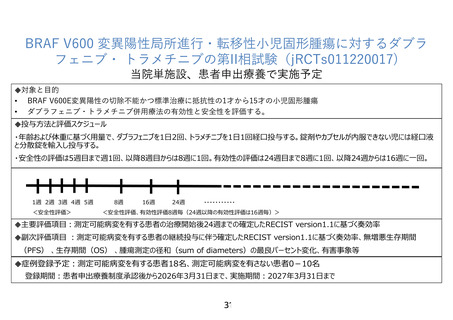
【別添4】「BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラ
フェニブ・トラメチニブの第 II 相試験」の有効性及び安全性の評価(意見書よ
り抜粋)
7-1.有効性及び安全性の評価
主要評価項目:
測定可能病変を有する患者の治療開始後 24 週までの確定した RECIST version1.1 に基
づく奏効率
副次評価項目
有効性の副次評価項目
測定可能病変を有する患者の継続投与に伴う確定した RECIST version1.1 に基づく奏効
率
測定可能病変を有する研究対象者の RECIST version 1.1 に基づく奏効率のうち、測定
可能病変がある原発性脳腫瘍の患者の最良総合効果を Response Assessment in NeuroOncology(RANO)に基づく評価に置き換えたもの
原発性脳腫瘍の患者の RANO に基づく奏効率、測定可能病変を有する患者と有さない患
者を含めた病勢制御割合・無増悪生存期間・全生存期間、
安全性の副次評価項目
重篤な有害事象(serious adverse event:SAE)
研究治療下で発現した有害事象(treatment-emergent adverse event:TEAE)
減量、休薬及び中止に至った TEAE
36
10. 登録前 3 ヶ月以内にうっ血性心不全の既往歴がある、またはうっ血性心不全を合併
している。
11. RAS の活性化変異が確認された悪性腫瘍又は BRAF-KIAA1549 などの BRAF 融合を伴う
悪性腫瘍の既往がある。
12. B 型肝炎ウイルス又は C 型肝炎ウイルス感染の既往を有する。
13. 網膜静脈閉塞症(RVO)又は中心性漿液性脈絡網膜症の既往を有するか現時点でこれ
らの所見が認められる
14. 研究責任医師あるいは研究分担医師が不適格と考える
【別添4】「BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラ
フェニブ・トラメチニブの第 II 相試験」の有効性及び安全性の評価(意見書よ
り抜粋)
7-1.有効性及び安全性の評価
主要評価項目:
測定可能病変を有する患者の治療開始後 24 週までの確定した RECIST version1.1 に基
づく奏効率
副次評価項目
有効性の副次評価項目
測定可能病変を有する患者の継続投与に伴う確定した RECIST version1.1 に基づく奏効
率
測定可能病変を有する研究対象者の RECIST version 1.1 に基づく奏効率のうち、測定
可能病変がある原発性脳腫瘍の患者の最良総合効果を Response Assessment in NeuroOncology(RANO)に基づく評価に置き換えたもの
原発性脳腫瘍の患者の RANO に基づく奏効率、測定可能病変を有する患者と有さない患
者を含めた病勢制御割合・無増悪生存期間・全生存期間、
安全性の副次評価項目
重篤な有害事象(serious adverse event:SAE)
研究治療下で発現した有害事象(treatment-emergent adverse event:TEAE)
減量、休薬及び中止に至った TEAE
36