よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
歳以上 10 歳未満:1.2 mg/dl 以下,10歳以上:1.5 mg/dl以下)
⑦ 心電図(ECG)測定 QTcF≦480 ms
9) 研究参加について代諾者(親権者、後見人に準ずるもので、研究対象者の最善の益を図
りうる者)から文書で同意が得られていること。7 歳以上については原則として研究対
象者本人から、年齢に応じたアセント文書で同意取得を得られていること。
除外基準
1) 活動性の重複がんを有する(同時性重複がん/多発がんおよび無病期間が5年以内の異時
性重複がん/多発がん。ただし局所治療により治癒と判断される Carcinoma in situ上
皮内癌や粘膜内癌相当の病変は活動性の重複がん/多発がんに含めない)
2) 全身的治療を要する感染症を有する
3) 登録時に38℃以上の発熱を有する
4) 妊娠中、授乳中の女性
5) ステロイド剤またはその他の免疫抑制剤の継続的な全身投与(内服または静脈内)を受
けている
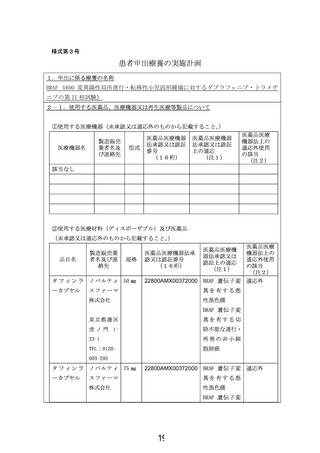
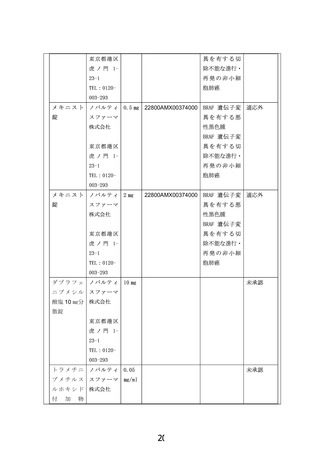
6) ダブラフェニブメシル酸塩などのBRAF阻害薬、トラメチニブジメチルスルホキシド付加
物などのMEK阻害剤を内服したことがある
7) 併用禁止薬を使用している患者や試験中に併用禁止薬を使用する必要がある
8) 登録前3 ヵ月以内に自家又は同種幹細胞移植を受けている
9) インスリンの継続的使用による治療中、またはコントロール不良の糖尿病を合併してい
る
10) 登録前3ヶ月以内にうっ血性心不全の既往歴がある、またはうっ血性心不全を合併して
いる。
11) RASの活性化変異が確認された悪性腫瘍又はBRAF-KIAA1549などのBRAF融合を伴う悪性腫
瘍の既往がある。
12) B 型肝炎ウイルス又はC 型肝炎ウイルス感染の既往を有する。
13) 網膜静脈閉塞症(RVO)又は中心性漿液性脈絡網膜症の既往を有するか現時点でこれら
の所見が認められる
14) 研究責任医師あるいは研究分担医師が不適格と考える
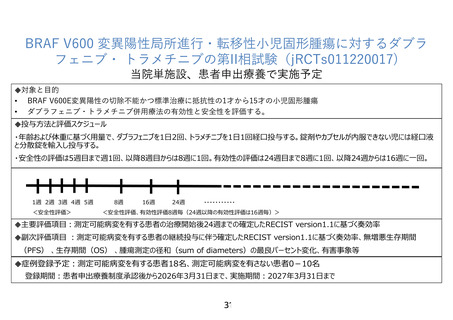
6.治療計画
研究薬ダブラフェニブメシル酸塩を、体重及び年齢に基づく用量で、1 日 2 回経口投与する。
研究薬トラメチニブジメチルスルホキシド付加物を、体重に基づく用量で、1 日 1 回経口投
与する。プロトコール治療中止基準のいずれかに該当するまで投与を繰り返す。
24
⑦ 心電図(ECG)測定 QTcF≦480 ms
9) 研究参加について代諾者(親権者、後見人に準ずるもので、研究対象者の最善の益を図
りうる者)から文書で同意が得られていること。7 歳以上については原則として研究対
象者本人から、年齢に応じたアセント文書で同意取得を得られていること。
除外基準
1) 活動性の重複がんを有する(同時性重複がん/多発がんおよび無病期間が5年以内の異時
性重複がん/多発がん。ただし局所治療により治癒と判断される Carcinoma in situ上
皮内癌や粘膜内癌相当の病変は活動性の重複がん/多発がんに含めない)
2) 全身的治療を要する感染症を有する
3) 登録時に38℃以上の発熱を有する
4) 妊娠中、授乳中の女性
5) ステロイド剤またはその他の免疫抑制剤の継続的な全身投与(内服または静脈内)を受
けている
6) ダブラフェニブメシル酸塩などのBRAF阻害薬、トラメチニブジメチルスルホキシド付加
物などのMEK阻害剤を内服したことがある
7) 併用禁止薬を使用している患者や試験中に併用禁止薬を使用する必要がある
8) 登録前3 ヵ月以内に自家又は同種幹細胞移植を受けている
9) インスリンの継続的使用による治療中、またはコントロール不良の糖尿病を合併してい
る
10) 登録前3ヶ月以内にうっ血性心不全の既往歴がある、またはうっ血性心不全を合併して
いる。
11) RASの活性化変異が確認された悪性腫瘍又はBRAF-KIAA1549などのBRAF融合を伴う悪性腫
瘍の既往がある。
12) B 型肝炎ウイルス又はC 型肝炎ウイルス感染の既往を有する。
13) 網膜静脈閉塞症(RVO)又は中心性漿液性脈絡網膜症の既往を有するか現時点でこれら
の所見が認められる
14) 研究責任医師あるいは研究分担医師が不適格と考える
6.治療計画
研究薬ダブラフェニブメシル酸塩を、体重及び年齢に基づく用量で、1 日 2 回経口投与する。
研究薬トラメチニブジメチルスルホキシド付加物を、体重に基づく用量で、1 日 1 回経口投
与する。プロトコール治療中止基準のいずれかに該当するまで投与を繰り返す。
24