よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
様式第5号
患者申出療養の内容 (概要)
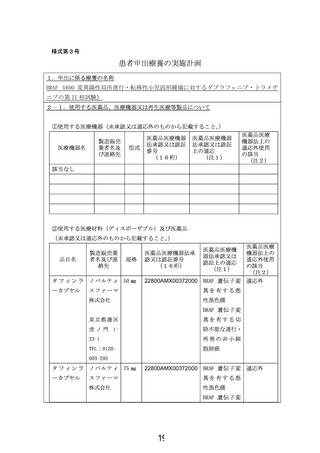
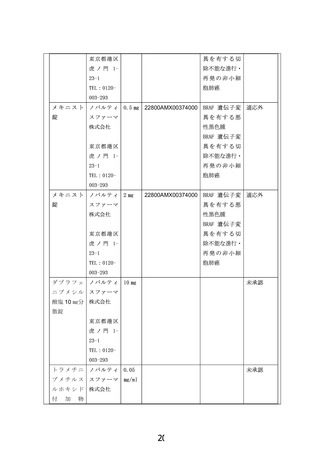
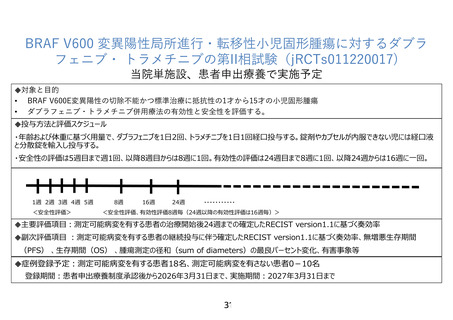
申出に係る療養の名称:BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラフェニブ・
トラメチニブの第 II 相試験
適応症:BRAF V600 変異陽性局所進行・転移性小児固形腫瘍
内容:
(概要)
遺伝子パネル検査の普及によって、小児患者においても低悪性度神経膠腫(LGG)を含む種々の固
形腫瘍に BRAF V600 変異が検出されるようになった。本試験では、我が国で保険適用済みの遺伝子パ
ネル検査によって BRAF V600 変異陽性と判明した局所進行・転移性小児固形腫瘍を有する生後 12 か
月以上 15 歳以下の小児患者に対して、ダブラフェニブ・トラメチニブ併用療法の有効性と安全性を評
価する。
主要評価項目は、測定可能病変を有する患者の治療開始後24週までの確定した RECIST version1.1
に基づく奏効率とする。
副次的評価項目は、測定可能病変を有する患者の継続投与に伴う確定した RECIST version 1.1 に基
づく奏効率、RECIST version 1.1 に基づいて評価した測定可能病変の径和の最良パーセント変化、測
定可能病変を有する研究対象者の RECIST version 1.1 に基づく奏効率のうち、測定可能病変がある原
発性脳腫瘍の患者の最良総合効果を Response Assessment in Neuro-Oncology(RANO)に基づく評
価に置き換えたもの、原発性脳腫瘍の患者の RANO に基づく奏効率、測定可能病変を有する患者と有
さない患者を含めた病勢制御割合・無増悪生存期間・全生存期間、有害事象とする。
(効果)
ダブラフェニブ・トラメチニブ併用療法は、BRAFV600 変異を有する切除不能または転移性悪性黒色
腫、および、BRAFV600 変異を有する非小細胞肺癌に対して我が国で承認されている。FDAではこれらの
承認に加え、2022年6月に、6歳以上のBRAF V600E陽性の固形腫瘍に対するダブラフェニブ・トラメチニ
ブ併用療法の適応拡大を行った。
この適応拡大は、成人対象のBRAF V600E変異陽性の固形腫瘍に対する第II相バスケット試験である
BRF117019試験(NCT02034110)とNCI-MATCH試験(NCT2465060) (Arm H)、および小児対象のBRAF V600変
異陽性の固形腫瘍に対する第I/II相試験であるX2101試験(NCT02124772)の結果に基づいて行われた。
小児対象のX2101試験に含まれる患者の中で、同併用療法を行った36例のLGGを有する患者における奏
効率が報告され、25%(95%CI、12.1~42.2)であった。
成人対象の上記2試験におけるBRAF V600E陽性固形腫瘍に対する同併用療法の奏効率は、胆道癌(n =
48)46%、高悪性度神経膠腫(HGG)(n = 48)33%、LGG (n = 14) 50%、低悪性度漿液性卵巣癌(n = 5)
80%、小腸癌(n = 4) 50%など、種々のがん種で良好な結果が報告された。また、小児のBRAFV600変異
を有するWilms腫瘍や思春期・若年成人の膵腺房細胞癌に対してダブラフェニブ・トラメチニブ併用療
法が有効であったとする症例報告がある。
以上より、小児患者においても、神経膠腫を含むBRAF V600E変異陽性の固形腫瘍に対する同併用療法
の効果が期待される。
17
患者申出療養の内容 (概要)
申出に係る療養の名称:BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラフェニブ・
トラメチニブの第 II 相試験
適応症:BRAF V600 変異陽性局所進行・転移性小児固形腫瘍
内容:
(概要)
遺伝子パネル検査の普及によって、小児患者においても低悪性度神経膠腫(LGG)を含む種々の固
形腫瘍に BRAF V600 変異が検出されるようになった。本試験では、我が国で保険適用済みの遺伝子パ
ネル検査によって BRAF V600 変異陽性と判明した局所進行・転移性小児固形腫瘍を有する生後 12 か
月以上 15 歳以下の小児患者に対して、ダブラフェニブ・トラメチニブ併用療法の有効性と安全性を評
価する。
主要評価項目は、測定可能病変を有する患者の治療開始後24週までの確定した RECIST version1.1
に基づく奏効率とする。
副次的評価項目は、測定可能病変を有する患者の継続投与に伴う確定した RECIST version 1.1 に基
づく奏効率、RECIST version 1.1 に基づいて評価した測定可能病変の径和の最良パーセント変化、測
定可能病変を有する研究対象者の RECIST version 1.1 に基づく奏効率のうち、測定可能病変がある原
発性脳腫瘍の患者の最良総合効果を Response Assessment in Neuro-Oncology(RANO)に基づく評
価に置き換えたもの、原発性脳腫瘍の患者の RANO に基づく奏効率、測定可能病変を有する患者と有
さない患者を含めた病勢制御割合・無増悪生存期間・全生存期間、有害事象とする。
(効果)
ダブラフェニブ・トラメチニブ併用療法は、BRAFV600 変異を有する切除不能または転移性悪性黒色
腫、および、BRAFV600 変異を有する非小細胞肺癌に対して我が国で承認されている。FDAではこれらの
承認に加え、2022年6月に、6歳以上のBRAF V600E陽性の固形腫瘍に対するダブラフェニブ・トラメチニ
ブ併用療法の適応拡大を行った。
この適応拡大は、成人対象のBRAF V600E変異陽性の固形腫瘍に対する第II相バスケット試験である
BRF117019試験(NCT02034110)とNCI-MATCH試験(NCT2465060) (Arm H)、および小児対象のBRAF V600変
異陽性の固形腫瘍に対する第I/II相試験であるX2101試験(NCT02124772)の結果に基づいて行われた。
小児対象のX2101試験に含まれる患者の中で、同併用療法を行った36例のLGGを有する患者における奏
効率が報告され、25%(95%CI、12.1~42.2)であった。
成人対象の上記2試験におけるBRAF V600E陽性固形腫瘍に対する同併用療法の奏効率は、胆道癌(n =
48)46%、高悪性度神経膠腫(HGG)(n = 48)33%、LGG (n = 14) 50%、低悪性度漿液性卵巣癌(n = 5)
80%、小腸癌(n = 4) 50%など、種々のがん種で良好な結果が報告された。また、小児のBRAFV600変異
を有するWilms腫瘍や思春期・若年成人の膵腺房細胞癌に対してダブラフェニブ・トラメチニブ併用療
法が有効であったとする症例報告がある。
以上より、小児患者においても、神経膠腫を含むBRAF V600E変異陽性の固形腫瘍に対する同併用療法
の効果が期待される。
17