よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
品の薬剤提供を申請しましたが、有償無償に関わらず提供できないとの回答でした。一方、患者申出療
養制度で実施される場合は、人道的な見地より、当該医薬品の無償提供を行うことは可能との回答を頂
きました。この時点で、九州大学の患者申出療養は開始されておらず、患者申出療養制度での実施を
前提に、特定臨床研究の立案を進めていた経緯があります。
本試験立案の端緒となった児は亡くなりましたが、同変異を持つ難治性固形腫瘍の児は国内でも一
定数発生し、数名の患者が申し出ています。がんゲノム情報管理センターに 2019 年 8 月から現在まで
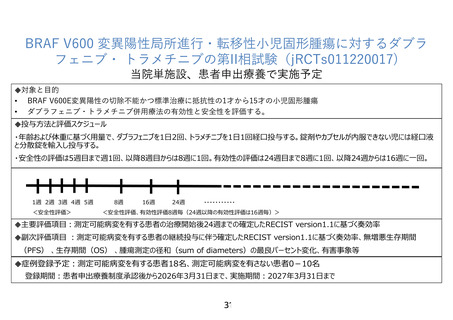
に登録された 1 才から 15 才の固形がん患者 807 例中、BRAF V600E 変異は 24 例(中枢神経腫瘍 21
例、その他の固形腫瘍 3 例)で認められております。被験者の安全性を確保する十分な情報伝達体制
を確保するため、単施設で施行することとしましたが、全国の申し出られた患者を組み入れて実施する
予定です。
5. 加えて、ここで申請者らが述べているように、もしも「承認につながら」ない現状を変えようとする
のであるならば、薬事承認までの道のりが遠い患者申出療養評価制度での実施ではなく、薬事承認
のための医師主導治験(あるいは国際治験データの外挿+小規模な企業国内第 3 相治験)を行うべ
きではないか。このことは、11.1 において本課題を「本医師主導研究」と称していることからも、申請
者ら自身にも自覚があるように推察される。
【回答】
製販企業のノバルティス社へ企業治験・拡大治験の実施予定を伺いましたが、BRAF V600 変異陽性
脳腫瘍を有する小児患者に対する国際共同治験(NCT02684058)の登録が終了している段階で、新な
治験や拡大治験を実施する予定がないとの回答でした。このため、医師主導治験や先進医療としての
当該医薬品の薬剤提供を申請しましたが、治験・拡大治験、先進医療の枠組みに対しては、有償無償
に関わらず提供できないとの回答でした。一方、患者申出療養制度で実施される場合は、人道的な見地
より、製販企業から当該医薬品の無償提供を行うことは可能との回答を頂きました。
治験、先進医療が望ましいことは十分自覚しておりますが、製販企業からの薬剤提供が、患者申出療
養制度のみで可能となることから、本申請を行っております。本試験で有望な結果が得られた場合は、
製販企業と相談し、企業治験または医師主導治験を実施することや、あるいは「医療上の必要性が高い
未承認薬・適応外薬検討会議」へ提案を行い、その後の医薬品の適応拡大・保険適用へ繋げることを目
指します。
また、上記の小児脳腫瘍の国際共同治験(NCT02684058)の結果により、6 歳以上の小児脳腫瘍患
者等への適応拡大が得られる可能性があります。この場合は、対象疾患や年齢等を変更して継続し、
最終的に 1-15 歳の BRAF V600 変異陽性の小児固形腫瘍全般への適応拡大を目指します。
6
12
養制度で実施される場合は、人道的な見地より、当該医薬品の無償提供を行うことは可能との回答を頂
きました。この時点で、九州大学の患者申出療養は開始されておらず、患者申出療養制度での実施を
前提に、特定臨床研究の立案を進めていた経緯があります。
本試験立案の端緒となった児は亡くなりましたが、同変異を持つ難治性固形腫瘍の児は国内でも一
定数発生し、数名の患者が申し出ています。がんゲノム情報管理センターに 2019 年 8 月から現在まで
に登録された 1 才から 15 才の固形がん患者 807 例中、BRAF V600E 変異は 24 例(中枢神経腫瘍 21
例、その他の固形腫瘍 3 例)で認められております。被験者の安全性を確保する十分な情報伝達体制
を確保するため、単施設で施行することとしましたが、全国の申し出られた患者を組み入れて実施する
予定です。
5. 加えて、ここで申請者らが述べているように、もしも「承認につながら」ない現状を変えようとする
のであるならば、薬事承認までの道のりが遠い患者申出療養評価制度での実施ではなく、薬事承認
のための医師主導治験(あるいは国際治験データの外挿+小規模な企業国内第 3 相治験)を行うべ
きではないか。このことは、11.1 において本課題を「本医師主導研究」と称していることからも、申請
者ら自身にも自覚があるように推察される。
【回答】
製販企業のノバルティス社へ企業治験・拡大治験の実施予定を伺いましたが、BRAF V600 変異陽性
脳腫瘍を有する小児患者に対する国際共同治験(NCT02684058)の登録が終了している段階で、新な
治験や拡大治験を実施する予定がないとの回答でした。このため、医師主導治験や先進医療としての
当該医薬品の薬剤提供を申請しましたが、治験・拡大治験、先進医療の枠組みに対しては、有償無償
に関わらず提供できないとの回答でした。一方、患者申出療養制度で実施される場合は、人道的な見地
より、製販企業から当該医薬品の無償提供を行うことは可能との回答を頂きました。
治験、先進医療が望ましいことは十分自覚しておりますが、製販企業からの薬剤提供が、患者申出療
養制度のみで可能となることから、本申請を行っております。本試験で有望な結果が得られた場合は、
製販企業と相談し、企業治験または医師主導治験を実施することや、あるいは「医療上の必要性が高い
未承認薬・適応外薬検討会議」へ提案を行い、その後の医薬品の適応拡大・保険適用へ繋げることを目
指します。
また、上記の小児脳腫瘍の国際共同治験(NCT02684058)の結果により、6 歳以上の小児脳腫瘍患
者等への適応拡大が得られる可能性があります。この場合は、対象疾患や年齢等を変更して継続し、
最終的に 1-15 歳の BRAF V600 変異陽性の小児固形腫瘍全般への適応拡大を目指します。
6
12