よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (28 ページ)
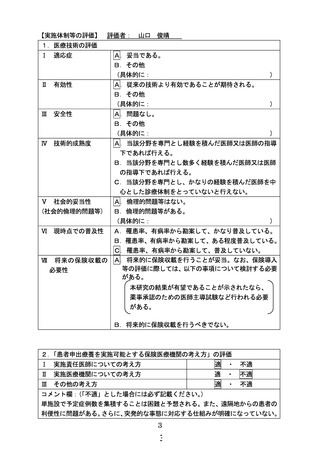
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
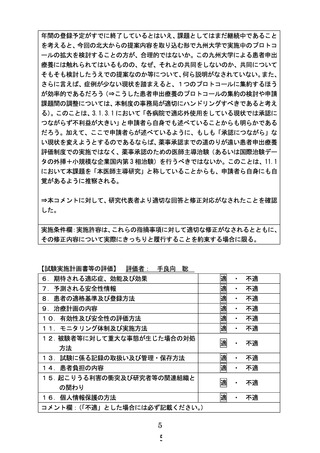
本研究から特許権、またそれを基として経済的利益が生じる可能性があるが、その権利は研
究対象者になく、研究を実施する実施医療機関の研究に従事する者に帰属する。
13.個人情報保護の方法
本研究の実施により得られた研究対象者に関する情報は、研究に従事する者が登録時に新た
に付与する固有の番号(研究対象者識別コード)によって識別することとし、その際特定の
個人を識別することができないようにするための適切な措置を講じるものとし、特定の個人
の識別に繋がる情報を用いない。研究責任医師は、研究対象者の氏名と研究対象者識別コー
ドの対応表を作成し、実施医療機関内の施錠可能な場所で適切に保管する。
14.試験計画の公表方法(下記のいずれかへの登録の有無)
・厚生労働省が整備するデータベース(jRCT) (○
有・無・予定)
「登録 ID 番号:jRCTs011220017 」
・大学病院医療情報ネットワーク(UMIN)「臨床試験登録システム」
(有・○
無の場合は登録予定日(
)
)
「登録 ID 番号:
」
・(財)日本医薬情報センター(JAPIC)「臨床試験情報」 (有・無
○・予定)
「登録 ID 番号:
」
・(社)日本医師会治験促進センター「臨床試験登録システム」 (有・○
無・予定)
「登録 ID 番号:
」
・その他(
)
(複数のデータベースに重複して登録しないよう注意すること)
15.技術的成熟度
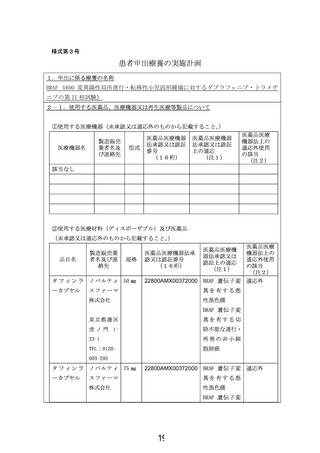
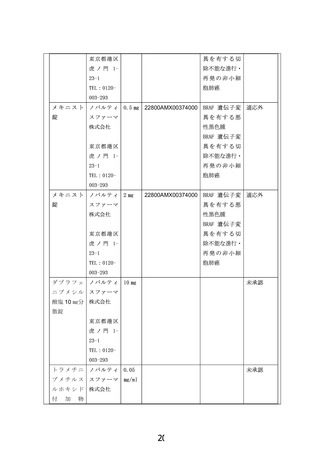
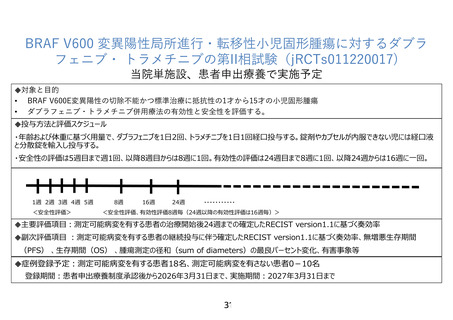
ダブラフェニブ・トラメチニブ併用療法は、成人におけるBRAFV600E/K変異を有する悪性黒色
腫、およびBRAFV600E変異を有する非小細胞肺癌に対して、本邦を含む世界各国で承認されて
いる。FDAでは、これらの承認に加え、2022年6月に、6歳以上のBRAF V600E陽性の固形腫瘍対
する適応拡大を行った1)2)。
この適応拡大は、成人対象のBRAF V600E変異陽性の固形腫瘍に対する第II相バスケット試験
であるBRF117019試験(NCT02034110)3)4)とNCI-MATCH試験(NCT2465060) (Arm H)5)、および小児
対象のBRAF V600変異陽性の固形腫瘍に対する第I/II相試験であるX2101試験(NCT02124772)
6)
の結果に基づいて行われた1)2)。
X2101試験の結果は、2022年11月に論文発表された6)。本試験は、18歳未満のBRAF V600変異陽
性の再発/難治性悪性腫瘍患者を対象とした第I/II相試験であり、トラメチニブ単独療法の
用量設定(パートA)および疾患特異的拡大(パートB)、ダブラフェニブ+トラメチニブの
用量設定(パートC)および疾患特異的拡大(パートD)の4つのパートから構成された。パー
トAおよびCにより、小児患者におけるダブラフェニブ・トラメチニブの併用療法におけるト
ラメチニブの推奨用量が、6歳未満の患者で1日1回0.032 mg/kg、6歳以上の患者で1日1回0.025
mg/kg、ダブラフェニブの推奨用量が、12歳未満の患者で1日5.25 mg/kg、2分割、12歳以上の
患者で1日4.5 mg/kg、2分割と設定された。
4 つのパートに含まれた 49 名の BRAF V600 変異陽性神経膠腫(LGG 47 例、HCG 2 例)
患者における独立評価による客観的奏効率は、トラメチニブ単独療法(13 例)で 15%(95%
28
究対象者になく、研究を実施する実施医療機関の研究に従事する者に帰属する。
13.個人情報保護の方法
本研究の実施により得られた研究対象者に関する情報は、研究に従事する者が登録時に新た
に付与する固有の番号(研究対象者識別コード)によって識別することとし、その際特定の
個人を識別することができないようにするための適切な措置を講じるものとし、特定の個人
の識別に繋がる情報を用いない。研究責任医師は、研究対象者の氏名と研究対象者識別コー
ドの対応表を作成し、実施医療機関内の施錠可能な場所で適切に保管する。
14.試験計画の公表方法(下記のいずれかへの登録の有無)
・厚生労働省が整備するデータベース(jRCT) (○
有・無・予定)
「登録 ID 番号:jRCTs011220017 」
・大学病院医療情報ネットワーク(UMIN)「臨床試験登録システム」
(有・○
無の場合は登録予定日(
)
)
「登録 ID 番号:
」
・(財)日本医薬情報センター(JAPIC)「臨床試験情報」 (有・無
○・予定)
「登録 ID 番号:
」
・(社)日本医師会治験促進センター「臨床試験登録システム」 (有・○
無・予定)
「登録 ID 番号:
」
・その他(
)
(複数のデータベースに重複して登録しないよう注意すること)
15.技術的成熟度
ダブラフェニブ・トラメチニブ併用療法は、成人におけるBRAFV600E/K変異を有する悪性黒色
腫、およびBRAFV600E変異を有する非小細胞肺癌に対して、本邦を含む世界各国で承認されて
いる。FDAでは、これらの承認に加え、2022年6月に、6歳以上のBRAF V600E陽性の固形腫瘍対
する適応拡大を行った1)2)。
この適応拡大は、成人対象のBRAF V600E変異陽性の固形腫瘍に対する第II相バスケット試験
であるBRF117019試験(NCT02034110)3)4)とNCI-MATCH試験(NCT2465060) (Arm H)5)、および小児
対象のBRAF V600変異陽性の固形腫瘍に対する第I/II相試験であるX2101試験(NCT02124772)
6)
の結果に基づいて行われた1)2)。
X2101試験の結果は、2022年11月に論文発表された6)。本試験は、18歳未満のBRAF V600変異陽
性の再発/難治性悪性腫瘍患者を対象とした第I/II相試験であり、トラメチニブ単独療法の
用量設定(パートA)および疾患特異的拡大(パートB)、ダブラフェニブ+トラメチニブの
用量設定(パートC)および疾患特異的拡大(パートD)の4つのパートから構成された。パー
トAおよびCにより、小児患者におけるダブラフェニブ・トラメチニブの併用療法におけるト
ラメチニブの推奨用量が、6歳未満の患者で1日1回0.032 mg/kg、6歳以上の患者で1日1回0.025
mg/kg、ダブラフェニブの推奨用量が、12歳未満の患者で1日5.25 mg/kg、2分割、12歳以上の
患者で1日4.5 mg/kg、2分割と設定された。
4 つのパートに含まれた 49 名の BRAF V600 変異陽性神経膠腫(LGG 47 例、HCG 2 例)
患者における独立評価による客観的奏効率は、トラメチニブ単独療法(13 例)で 15%(95%
28