よむ、つかう、まなぶ。
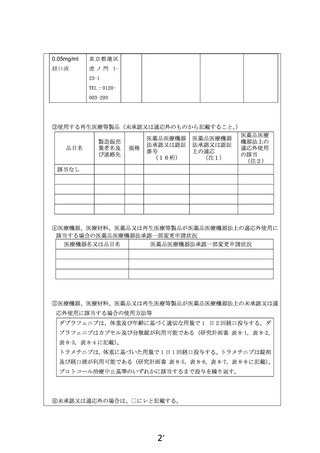
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
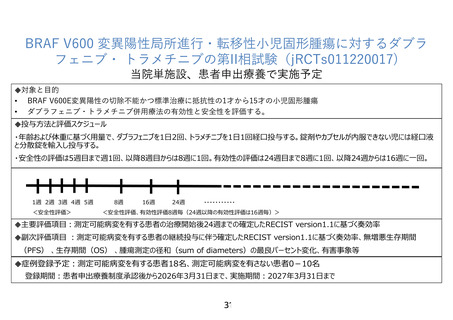
7-1.有効性及び安全性の評価
主要評価項目:
測定可能病変を有する患者の治療開始後 24 週までの確定した RECIST version1.1 に基づ
く奏効率
副次評価項目
有効性の副次評価項目
測定可能病変を有する患者の継続投与に伴う確定した RECIST version1.1 に基づく奏効
率
RECIST version 1.1 に基づいて評価した測定可能病変の径和の最良パーセント変化
測定可能病変を有する研究対象者の RECIST version 1.1 に基づく奏効率のうち、測定可
能病変がある原発性脳腫瘍の患者の最良総合効果を Response Assessment in NeuroOncology(RANO)に基づく評価に置き換えたもの
原発性脳腫瘍の患者の RANO に基づく奏効率、測定可能病変を有する患者と有さない患者
を含めた病勢制御割合・無増悪生存期間・全生存期間、
安全性の副次評価項目
重篤な有害事象(serious adverse event:SAE)
研究治療下で発現した有害事象(treatment-emergent adverse event:TEAE)
減量、休薬及び中止に至った TEAE
25
主要評価項目:
測定可能病変を有する患者の治療開始後 24 週までの確定した RECIST version1.1 に基づ
く奏効率
副次評価項目
有効性の副次評価項目
測定可能病変を有する患者の継続投与に伴う確定した RECIST version1.1 に基づく奏効
率
RECIST version 1.1 に基づいて評価した測定可能病変の径和の最良パーセント変化
測定可能病変を有する研究対象者の RECIST version 1.1 に基づく奏効率のうち、測定可
能病変がある原発性脳腫瘍の患者の最良総合効果を Response Assessment in NeuroOncology(RANO)に基づく評価に置き換えたもの
原発性脳腫瘍の患者の RANO に基づく奏効率、測定可能病変を有する患者と有さない患者
を含めた病勢制御割合・無増悪生存期間・全生存期間、
安全性の副次評価項目
重篤な有害事象(serious adverse event:SAE)
研究治療下で発現した有害事象(treatment-emergent adverse event:TEAE)
減量、休薬及び中止に至った TEAE
25