よむ、つかう、まなぶ。
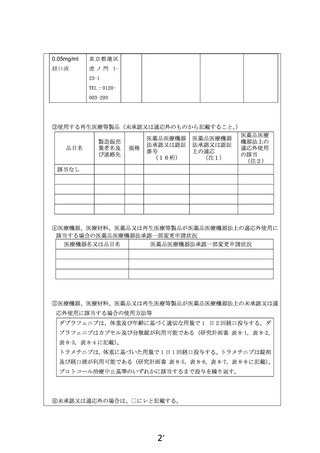
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
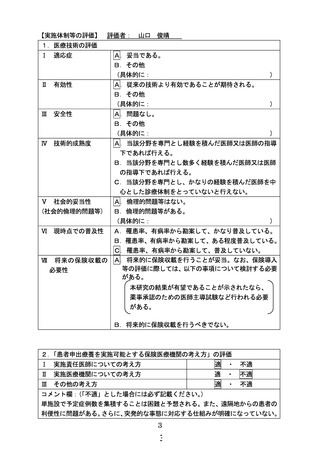
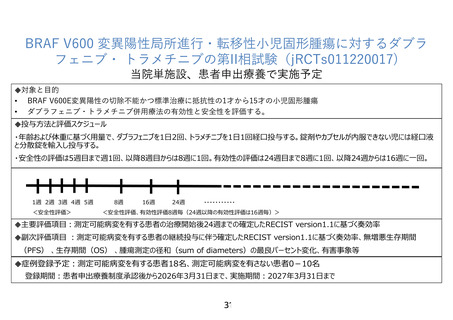
BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラ
フェニブ・ トラメチニブの第II相試験(jRCTs011220017)
当院単施設、患者申出療養で実施予定
対象と目的
• BRAF V600E変異陽性の切除不能かつ標準治療に抵抗性の1才から15才の小児固形腫瘍
• ダブラフェニブ・トラメチニブ併用療法の有効性と安全性を評価する。
投与方法と評価スケジュール
・年齢および体重に基づく用量で、ダブラフェニブを1日2回、トラメチニブを1日1回経口投与する。錠剤やカプセルが内服できない児には経口液
と分散錠を輸入し投与する。
・安全性の評価は5週目まで週1回、以降8週目からは8週に1回。有効性の評価は24週目まで8週に1回、以降24週からは16週に一回。
1週 2週 3週 4週 5週
<安全性評価>
8週
16週
24週
・・・・・・・・・・・
<安全性評価、有効性評価8週毎(24週以降の有効性評価は16週毎)>
主要評価項目:測定可能病変を有する患者の治療開始後24週までの確定したRECIST version1.1に基づく奏効率
副次評価項目 :測定可能病変を有する患者の継続投与に伴う確定したRECIST version1.1に基づく奏効率、無増悪生存期間
(PFS) 、生存期間(OS) 、腫瘍測定の径和(sum of diameters)の最良パーセント変化、有害事象等
症例登録予定:測定可能病変を有する患者18名、測定可能病変を有さない患者0-10名
登録期間:患者申出療養制度承認後から2026年3月31日まで、実施期間:2027年3月31日まで
31
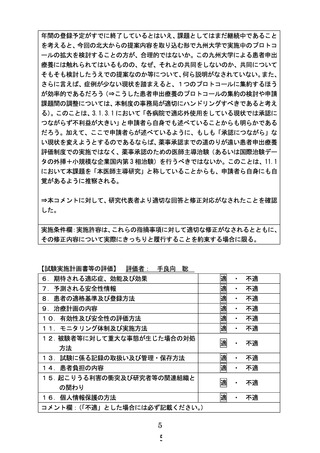
フェニブ・ トラメチニブの第II相試験(jRCTs011220017)
当院単施設、患者申出療養で実施予定
対象と目的
• BRAF V600E変異陽性の切除不能かつ標準治療に抵抗性の1才から15才の小児固形腫瘍
• ダブラフェニブ・トラメチニブ併用療法の有効性と安全性を評価する。
投与方法と評価スケジュール
・年齢および体重に基づく用量で、ダブラフェニブを1日2回、トラメチニブを1日1回経口投与する。錠剤やカプセルが内服できない児には経口液
と分散錠を輸入し投与する。
・安全性の評価は5週目まで週1回、以降8週目からは8週に1回。有効性の評価は24週目まで8週に1回、以降24週からは16週に一回。
1週 2週 3週 4週 5週
<安全性評価>
8週
16週
24週
・・・・・・・・・・・
<安全性評価、有効性評価8週毎(24週以降の有効性評価は16週毎)>
主要評価項目:測定可能病変を有する患者の治療開始後24週までの確定したRECIST version1.1に基づく奏効率
副次評価項目 :測定可能病変を有する患者の継続投与に伴う確定したRECIST version1.1に基づく奏効率、無増悪生存期間
(PFS) 、生存期間(OS) 、腫瘍測定の径和(sum of diameters)の最良パーセント変化、有害事象等
症例登録予定:測定可能病変を有する患者18名、測定可能病変を有さない患者0-10名
登録期間:患者申出療養制度承認後から2026年3月31日まで、実施期間:2027年3月31日まで
31