よむ、つかう、まなぶ。
【資料3-3】新型コロナワクチン 心筋炎関連事象の安全性評価について(健康局及び医薬・生活衛生局 の説明資料) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
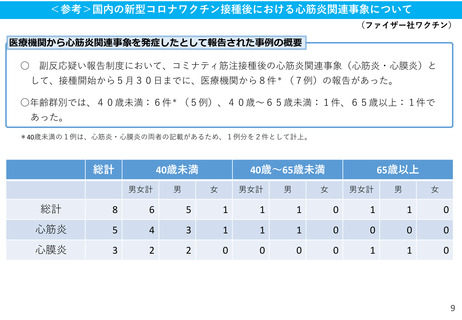
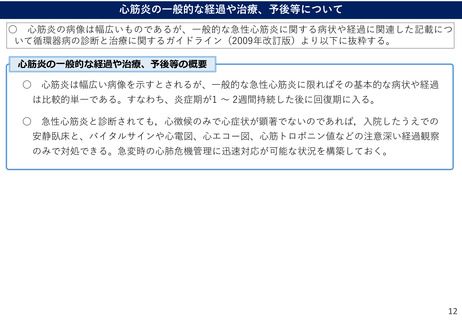
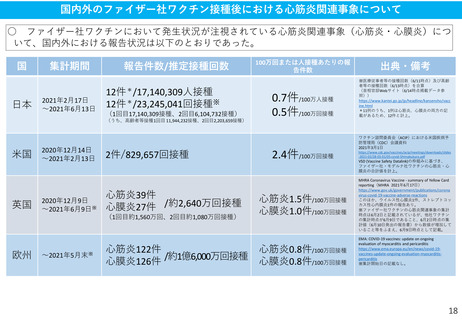
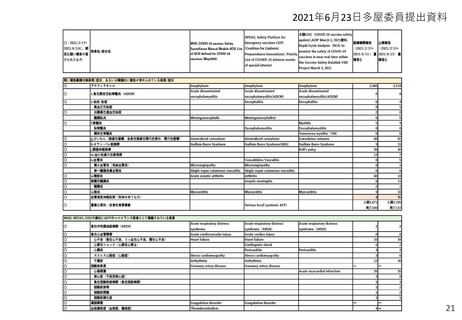
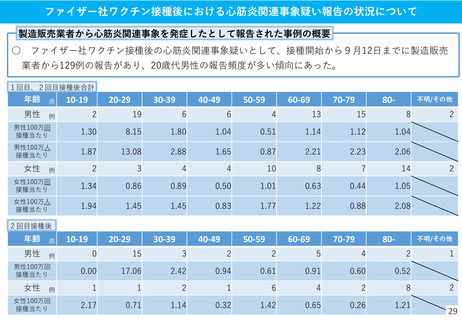
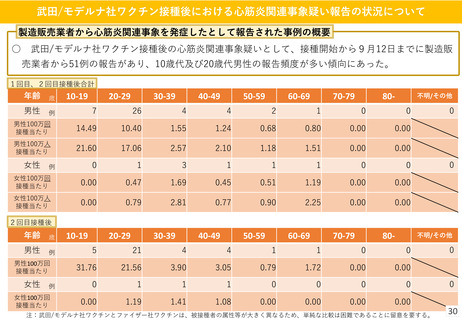
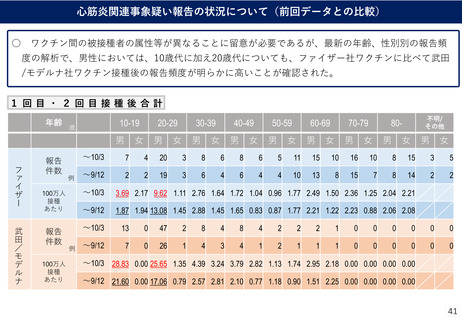
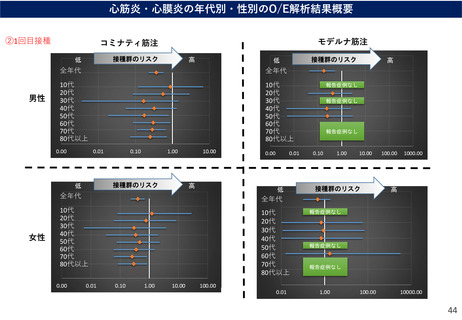
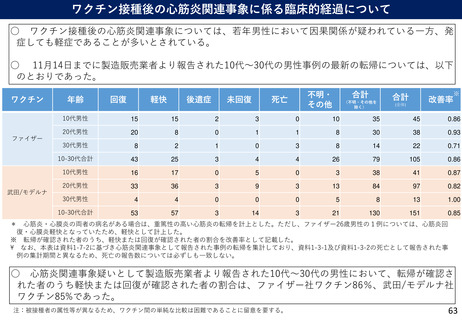
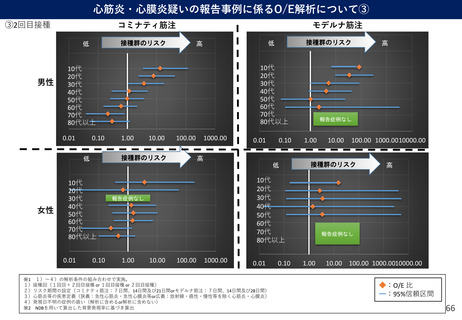
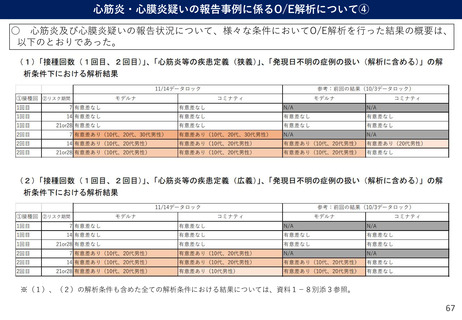
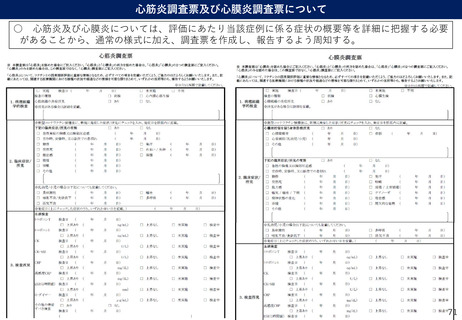
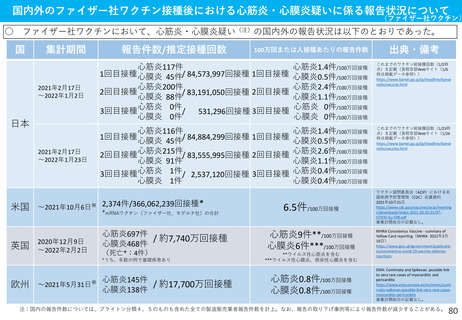
(参考)副反応疑い報告基準の設定について
<予防接種法における副反応疑い報告制度について>
○
制度の趣旨
副反応疑い報告制度は、予防接種後に生じる種々の身体的反応や副反応等について情報を収集し、
ワクチンの安全性について管理・検討を行うことで、広く国民に情報を提供すること及び今後の予防
接種行政の推進に資することを目的としている。
○
報告の義務【予防接種法第12 条1項】
「病院若しくは診療所の開設者又は医師は、定期の予防接種等を受けた者が、当該定期の予防接種
等を受けたことによるものと疑われる症状として厚生労働省令で定めるものを呈していることを知っ
たときは、その旨を厚生労働省令で定めるところにより厚生労働大臣に報告しなければならない。」
○
報告の要件
病院若しくは診療所の開設者又は医師が予防接種法施行規則第5条に規定する症状を診断した場合
新型コロワクチンを臨時接種に位置付けるにあたり、副反応疑い報告基準を定める必要があ
る。
具体的には、副反応疑い報告の収集に当たり、どのような症状を類型化し、定めるかについ
て整理する必要がある。
あわせて、副反応疑い報告基準に定める、接種後に症状が発生するまでの期間の設定につい
ても整理する必要がある。
3
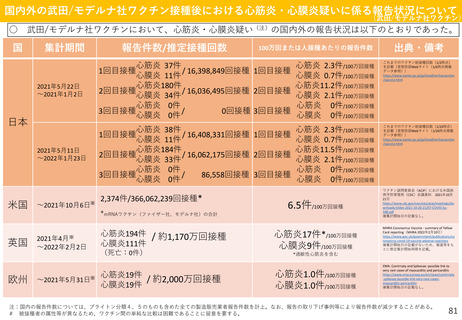
<予防接種法における副反応疑い報告制度について>
○
制度の趣旨
副反応疑い報告制度は、予防接種後に生じる種々の身体的反応や副反応等について情報を収集し、
ワクチンの安全性について管理・検討を行うことで、広く国民に情報を提供すること及び今後の予防
接種行政の推進に資することを目的としている。
○
報告の義務【予防接種法第12 条1項】
「病院若しくは診療所の開設者又は医師は、定期の予防接種等を受けた者が、当該定期の予防接種
等を受けたことによるものと疑われる症状として厚生労働省令で定めるものを呈していることを知っ
たときは、その旨を厚生労働省令で定めるところにより厚生労働大臣に報告しなければならない。」
○
報告の要件
病院若しくは診療所の開設者又は医師が予防接種法施行規則第5条に規定する症状を診断した場合
新型コロワクチンを臨時接種に位置付けるにあたり、副反応疑い報告基準を定める必要があ
る。
具体的には、副反応疑い報告の収集に当たり、どのような症状を類型化し、定めるかについ
て整理する必要がある。
あわせて、副反応疑い報告基準に定める、接種後に症状が発生するまでの期間の設定につい
ても整理する必要がある。
3