よむ、つかう、まなぶ。
【資料3-3】新型コロナワクチン 心筋炎関連事象の安全性評価について(健康局及び医薬・生活衛生局 の説明資料) (72 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
新型コロナワクチンの副反応疑い報告基準について
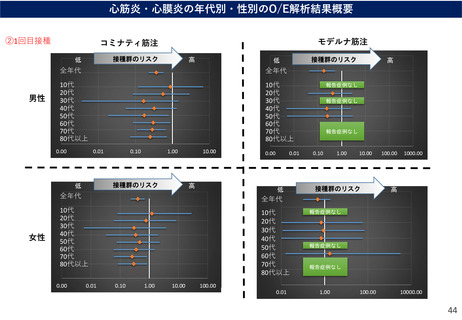
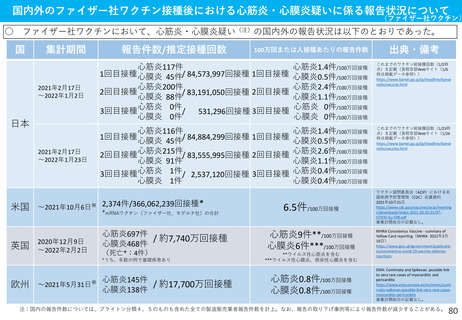
○ 国内外におけるワクチン接種後の心筋炎関連事象(心筋炎・心膜炎)の報告状況、及び最新の副反
応疑い報告数に基づくO/E解析の結果を踏まえ、新型コロナワクチンの副反応疑い報告基準について、
以下のとおりとしてはどうか。
論点
○
新型コロナワクチンに対する副反応疑い報告基準を、以下のように変更することとしてはどうか。
症状
期間
アナフィラキシー
4時間
血栓症(血栓塞栓症を含む。)(血小板減少症
を伴うものに限る。)
28日
心筋炎
28日
心膜炎
28日
その他※
予防接種との関連性が高いと医師が認める期間
※ その他医師が予防接種との関連性が高いと認める症状であって、入院治療を必要とするもの、
死亡、身体の機能の障害に至るもの又は死亡若しくは身体の機能の障害に至るおそれのあるもの
○
臨時接種の対象である全ての新型コロナワクチンにおいて同一の報告基準としてよいか。
72
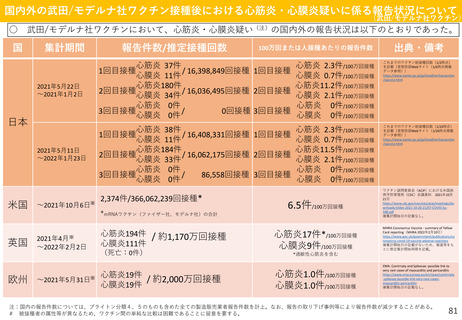
○ 国内外におけるワクチン接種後の心筋炎関連事象(心筋炎・心膜炎)の報告状況、及び最新の副反
応疑い報告数に基づくO/E解析の結果を踏まえ、新型コロナワクチンの副反応疑い報告基準について、
以下のとおりとしてはどうか。
論点
○
新型コロナワクチンに対する副反応疑い報告基準を、以下のように変更することとしてはどうか。
症状
期間
アナフィラキシー
4時間
血栓症(血栓塞栓症を含む。)(血小板減少症
を伴うものに限る。)
28日
心筋炎
28日
心膜炎
28日
その他※
予防接種との関連性が高いと医師が認める期間
※ その他医師が予防接種との関連性が高いと認める症状であって、入院治療を必要とするもの、
死亡、身体の機能の障害に至るもの又は死亡若しくは身体の機能の障害に至るおそれのあるもの
○
臨時接種の対象である全ての新型コロナワクチンにおいて同一の報告基準としてよいか。
72