よむ、つかう、まなぶ。
総-1-1○医薬品の新規薬価収載等について (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00254.html |
| 出典情報 | 中央社会保険医療協議会 総会(第589回 5/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
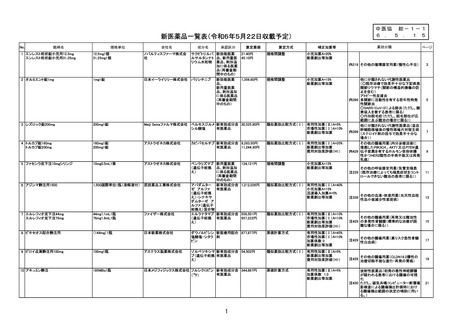
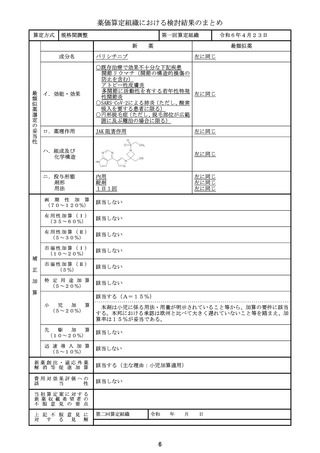
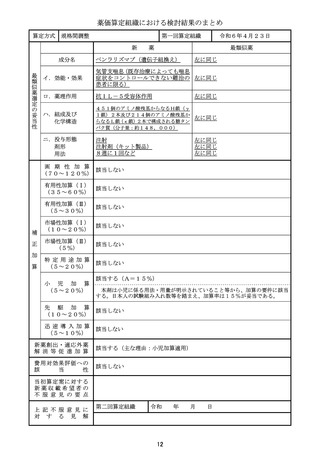
薬価算定組織における検討結果のまとめ
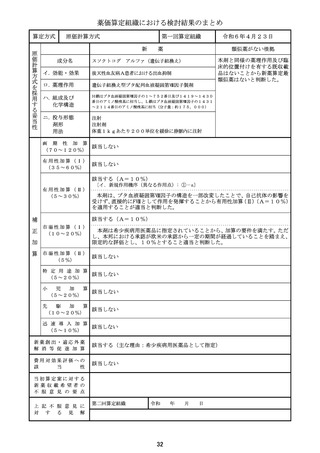
算定方式
類似薬効比較方式(Ⅰ)
第一回算定組織
新
薬
最類似薬
アパダムターゼ アルファ(遺伝子組換
え)/シナキサダムターゼ アルファ(遺伝 カプラシズマブ(遺伝子組換え)
子組換え)混合物
成分名
最
類
似
薬
選
定
の
妥
当
性
令和6年4月23日
イ.効能・効果
先天性血栓性血小板減少性紫斑病
後天性血栓性血小板減少性紫斑病
ロ.薬理作用
ADAMTS13の補充
von willebrand因子媒介血
小板凝集抑制作用
ハ.組成及び
化学構造
いずれも、1353個のアミノ酸残基からなる糖タ
ンパク質(分子量:約173,000)
259個のアミノ酸残基からなるタンパク質
ニ.投与形態
剤形
用法
注射
注射剤
2週に1回又は1日1回
左に同じ
左に同じ
1日1回
画 期 性 加 算
(70~120%)
該当しない
該当する(A=40%)
〔イ.新規作用機序(異なる標的分子): ①-b=1p〕
〔ハ.治療方法の改善(標準的治療法、利便性: ③-b, ③-c=2p〕
有用性加算(Ⅰ)
(35~60%)
補
正
加
算
本剤は対象疾患の治療におけるはじめての遺伝子組換えvWF切断酵素(ADAMTS1
3)であり、「血栓性血小板減少性紫斑病診療ガイド2023」において対象疾患におけ
る治療の第一選択として、ADAMTS13の補充を目的とした新鮮凍結人血漿製剤の輸
注が推奨されていること、新鮮凍結人血漿製剤の投与と比べて、より少量、かつ、短い時間
での投与となって患者負担の軽減につながることから、有用性加算(Ⅰ)(A=40%)を
適用することが適当と判断した。
有用性加算(Ⅱ)
(5~30%)
該当しない
市場性加算(Ⅰ)
(10~20%)
該当しない
市場性加算(Ⅱ)
(5%)
該当しない
特 定 用 途 加 算
(5~20%)
該当しない
小
先
児
加
算
(5~20%)
駆
加
算
(10~20%)
該当する(A=15%)
本剤は小児に係る用法・用量が明示されていること等から、加算の要件に該当する。小
児日本人の試験組み入れ数等を踏まえ、加算率は15%が妥当である。
該当しない
該当する(A=5%)
迅 速 導 入 加 算
(5~10%)
本剤は国際共同治験により開発され、優先審査の対象であり、かつ本邦における承認申
請及び承認は欧米において最も早い承認申請及び承認から6か月以内であることから、加
算の要件を満たす。
新薬創出・適応外薬
解 消 等 促 進 加 算
該当する(主な理由:希少疾病用医薬品として指定)
費用対効果評価への
該
当
性
該当しない
当 初 算 定 案 に 対 す る
新 薬 収 載 希 望 者 の
不 服 意 見 の 要 点
上
対
記
不
す
服
る
意
見
見
に
解
第二回算定組織
令和
14
年
月
日
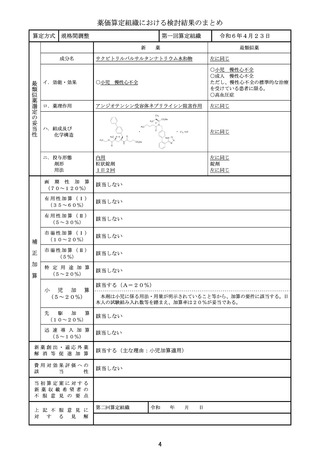
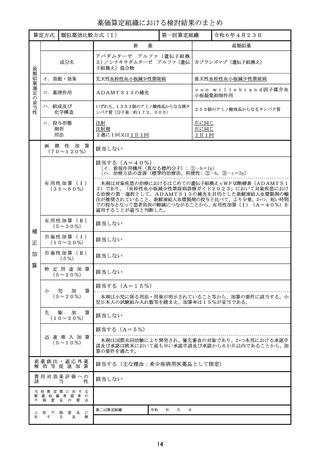
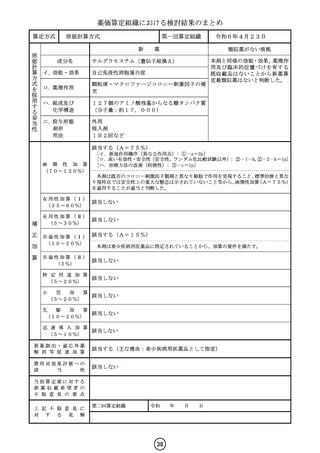
算定方式
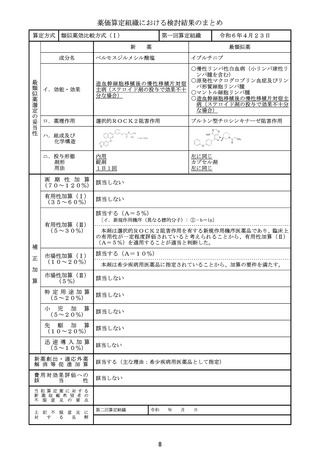
類似薬効比較方式(Ⅰ)
第一回算定組織
新
薬
最類似薬
アパダムターゼ アルファ(遺伝子組換
え)/シナキサダムターゼ アルファ(遺伝 カプラシズマブ(遺伝子組換え)
子組換え)混合物
成分名
最
類
似
薬
選
定
の
妥
当
性
令和6年4月23日
イ.効能・効果
先天性血栓性血小板減少性紫斑病
後天性血栓性血小板減少性紫斑病
ロ.薬理作用
ADAMTS13の補充
von willebrand因子媒介血
小板凝集抑制作用
ハ.組成及び
化学構造
いずれも、1353個のアミノ酸残基からなる糖タ
ンパク質(分子量:約173,000)
259個のアミノ酸残基からなるタンパク質
ニ.投与形態
剤形
用法
注射
注射剤
2週に1回又は1日1回
左に同じ
左に同じ
1日1回
画 期 性 加 算
(70~120%)
該当しない
該当する(A=40%)
〔イ.新規作用機序(異なる標的分子): ①-b=1p〕
〔ハ.治療方法の改善(標準的治療法、利便性: ③-b, ③-c=2p〕
有用性加算(Ⅰ)
(35~60%)
補
正
加
算
本剤は対象疾患の治療におけるはじめての遺伝子組換えvWF切断酵素(ADAMTS1
3)であり、「血栓性血小板減少性紫斑病診療ガイド2023」において対象疾患におけ
る治療の第一選択として、ADAMTS13の補充を目的とした新鮮凍結人血漿製剤の輸
注が推奨されていること、新鮮凍結人血漿製剤の投与と比べて、より少量、かつ、短い時間
での投与となって患者負担の軽減につながることから、有用性加算(Ⅰ)(A=40%)を
適用することが適当と判断した。
有用性加算(Ⅱ)
(5~30%)
該当しない
市場性加算(Ⅰ)
(10~20%)
該当しない
市場性加算(Ⅱ)
(5%)
該当しない
特 定 用 途 加 算
(5~20%)
該当しない
小
先
児
加
算
(5~20%)
駆
加
算
(10~20%)
該当する(A=15%)
本剤は小児に係る用法・用量が明示されていること等から、加算の要件に該当する。小
児日本人の試験組み入れ数等を踏まえ、加算率は15%が妥当である。
該当しない
該当する(A=5%)
迅 速 導 入 加 算
(5~10%)
本剤は国際共同治験により開発され、優先審査の対象であり、かつ本邦における承認申
請及び承認は欧米において最も早い承認申請及び承認から6か月以内であることから、加
算の要件を満たす。
新薬創出・適応外薬
解 消 等 促 進 加 算
該当する(主な理由:希少疾病用医薬品として指定)
費用対効果評価への
該
当
性
該当しない
当 初 算 定 案 に 対 す る
新 薬 収 載 希 望 者 の
不 服 意 見 の 要 点
上
対
記
不
す
服
る
意
見
見
に
解
第二回算定組織
令和
14
年
月
日