よむ、つかう、まなぶ。
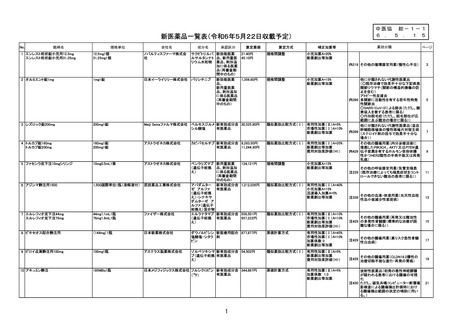
総-1-1○医薬品の新規薬価収載等について (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00254.html |
| 出典情報 | 中央社会保険医療協議会 総会(第589回 5/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
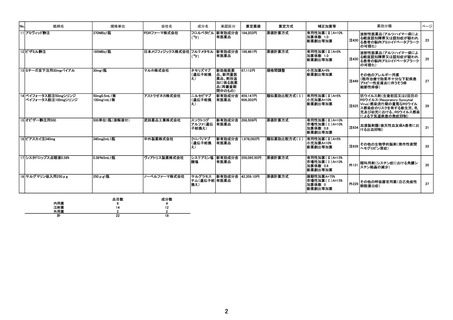
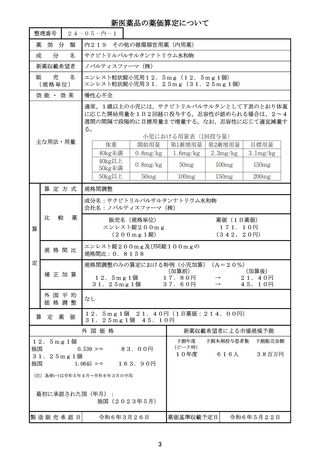
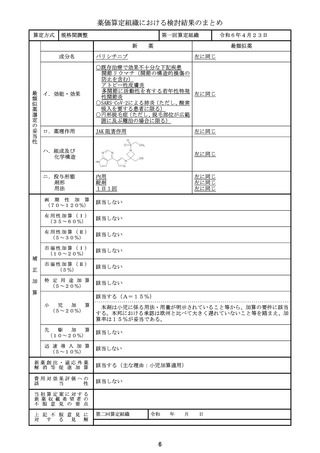
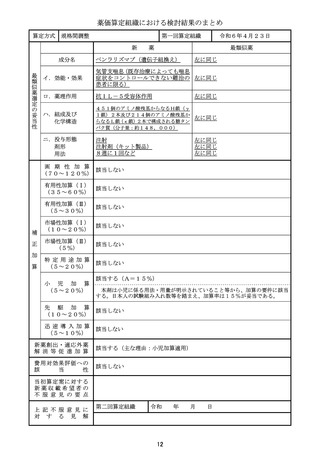
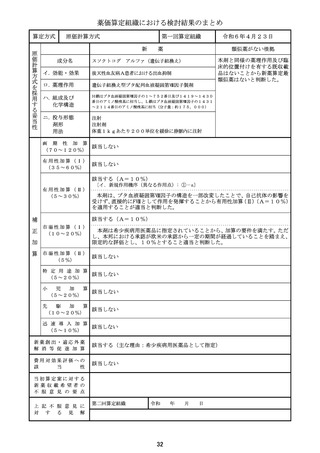
薬価算定組織における検討結果のまとめ
算定方式
原価計算方式
第一回算定組織
新
成分名
イ.効能・効果
原
価
計
算
方
式
を
採
用
す
る
妥
当
性
ロ.薬理作用
薬
令和6年4月23日
類似薬がない根拠
ダウノルビシン塩酸塩・シタラビン
本剤と一定程度の類似性のあるダ
ウノルビシン塩酸塩及びシタラビン
高リスク急性骨髄性白血病
は、いずれも効能・臨床的位置づけ
核酸合成阻害作用(DNAと結合/核酸合成過程の代 が異なると考えられ、また、薬価収
載から50年超が経過しており、新
謝阻害)
薬算定最類似薬は過去10年間に薬
ダウノルビシン塩酸塩・シタラビン
価収載されたものとする原則から外
れることなどを勘案し、新薬算定最
類似薬は存在しないと判断した。
ハ.組成及び
化学構造
リポソーム製剤
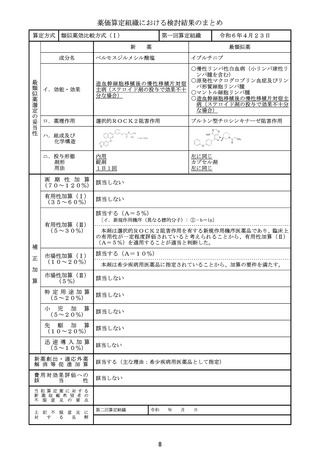
ニ.投与形態
剤形
用法
注射
注射剤
1日1回(寛解導入療法の場合、1サイクル目は1、3、
5日目、2サイクル目は1、3日目に、地固め療法の場合、
1サイクル目及び2サイクル目ともに1、3日目に点滴静注)
画 期 性 加 算 該当しない
(7 0 ~ 1 2 0 % )
該当する(A=45%)
〔ロ.高い有効性・安全性(有効性、ランダム化比較試験): ②-1-a,②-2-a=2p〕
〔ハ.治療方法の改善(標準的治療法、利便性): ③-b,③-c=2p〕
有用性加算(Ⅰ)
(35~60%)
補
正
加
算
本剤と強力化学療法(ダウノルビシン・シタラビン併用療法)とを直接比較した臨床試験
において、主要評価項目とされたOSについて、対照群に対する本剤群の優越性が検証され
たこと、また、既存治療に比して治療日数の短縮等が期待できること等から、有用性加算(Ⅰ)
(A=45%)を適用することが適当と判断した。
有 用 性 加 算 ( Ⅱ ) 該当しない
(5~30%)
該当する(A=10%)
市場性加算(Ⅰ)
(10~20%)
本剤は希少疾病用医薬品に指定されていることから、加算の要件を満たす。ただし、本邦
における承認が欧米の承認から一定の期間が経過していることを踏まえ、限定的な評価と
し、10%とすることが適当と判断した。
市場性加算(Ⅱ)
該当しない
(5%)
特 定 用 途 加 算 該当しない
(5~20%)
小
児
加
算
該当しない
(5~20%)
先
駆
加
算 該当しない
(10~20%)
迅 速 導 入 加 算
該当しない
(5~10%)
新薬創出・適応外薬
解 消 等 促 進 加 算
該当する(主な理由:希少疾病用医薬品として指定)
費用対効果評価への
該
当
性
該当しない
当初算定案に対する
新薬収載希望者の
不 服 意 見 の 要 点
上 記 不 服 意 見 に
対 す る 見 解
第二回算定組織
令和
18
年
月
日
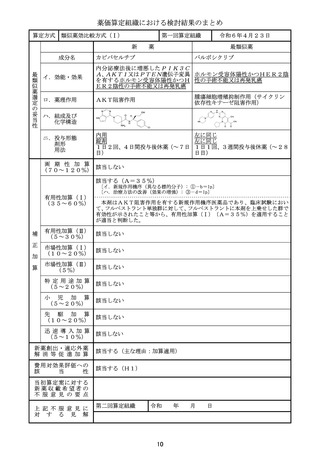
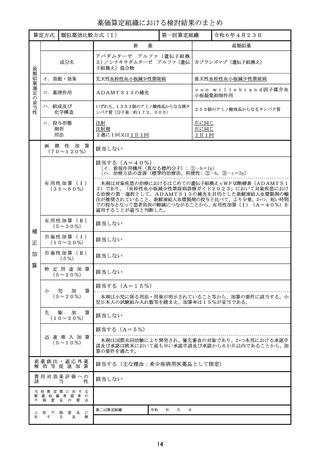
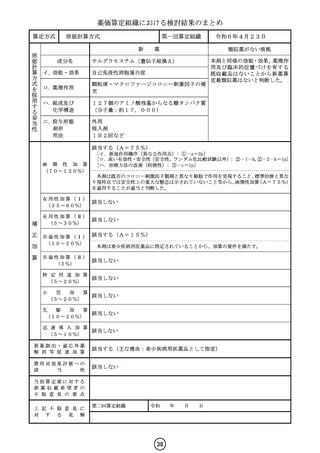
算定方式
原価計算方式
第一回算定組織
新
成分名
イ.効能・効果
原
価
計
算
方
式
を
採
用
す
る
妥
当
性
ロ.薬理作用
薬
令和6年4月23日
類似薬がない根拠
ダウノルビシン塩酸塩・シタラビン
本剤と一定程度の類似性のあるダ
ウノルビシン塩酸塩及びシタラビン
高リスク急性骨髄性白血病
は、いずれも効能・臨床的位置づけ
核酸合成阻害作用(DNAと結合/核酸合成過程の代 が異なると考えられ、また、薬価収
載から50年超が経過しており、新
謝阻害)
薬算定最類似薬は過去10年間に薬
ダウノルビシン塩酸塩・シタラビン
価収載されたものとする原則から外
れることなどを勘案し、新薬算定最
類似薬は存在しないと判断した。
ハ.組成及び
化学構造
リポソーム製剤
ニ.投与形態
剤形
用法
注射
注射剤
1日1回(寛解導入療法の場合、1サイクル目は1、3、
5日目、2サイクル目は1、3日目に、地固め療法の場合、
1サイクル目及び2サイクル目ともに1、3日目に点滴静注)
画 期 性 加 算 該当しない
(7 0 ~ 1 2 0 % )
該当する(A=45%)
〔ロ.高い有効性・安全性(有効性、ランダム化比較試験): ②-1-a,②-2-a=2p〕
〔ハ.治療方法の改善(標準的治療法、利便性): ③-b,③-c=2p〕
有用性加算(Ⅰ)
(35~60%)
補
正
加
算
本剤と強力化学療法(ダウノルビシン・シタラビン併用療法)とを直接比較した臨床試験
において、主要評価項目とされたOSについて、対照群に対する本剤群の優越性が検証され
たこと、また、既存治療に比して治療日数の短縮等が期待できること等から、有用性加算(Ⅰ)
(A=45%)を適用することが適当と判断した。
有 用 性 加 算 ( Ⅱ ) 該当しない
(5~30%)
該当する(A=10%)
市場性加算(Ⅰ)
(10~20%)
本剤は希少疾病用医薬品に指定されていることから、加算の要件を満たす。ただし、本邦
における承認が欧米の承認から一定の期間が経過していることを踏まえ、限定的な評価と
し、10%とすることが適当と判断した。
市場性加算(Ⅱ)
該当しない
(5%)
特 定 用 途 加 算 該当しない
(5~20%)
小
児
加
算
該当しない
(5~20%)
先
駆
加
算 該当しない
(10~20%)
迅 速 導 入 加 算
該当しない
(5~10%)
新薬創出・適応外薬
解 消 等 促 進 加 算
該当する(主な理由:希少疾病用医薬品として指定)
費用対効果評価への
該
当
性
該当しない
当初算定案に対する
新薬収載希望者の
不 服 意 見 の 要 点
上 記 不 服 意 見 に
対 す る 見 解
第二回算定組織
令和
18
年
月
日