よむ、つかう、まなぶ。
総-1-1○医薬品の新規薬価収載等について (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00254.html |
| 出典情報 | 中央社会保険医療協議会 総会(第589回 5/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
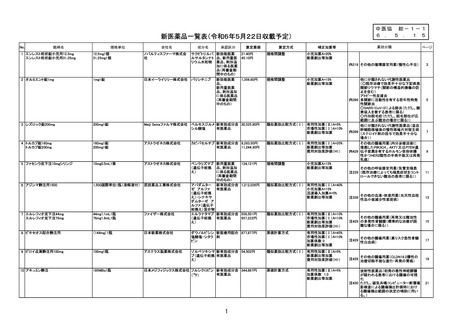
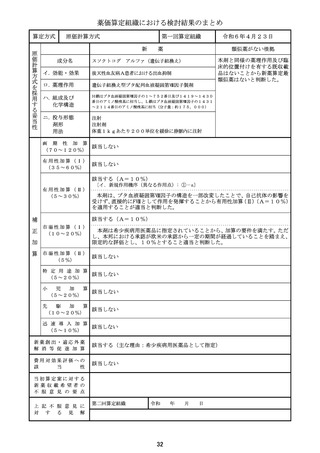
新医薬品の薬価算定について
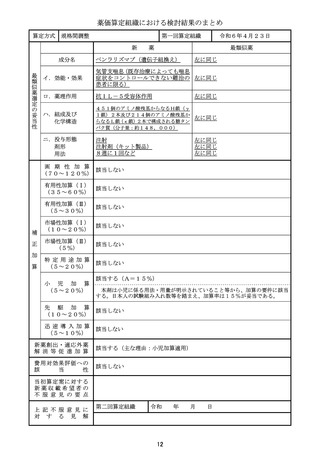
整理番号
24-05-注-4
薬 効 分
類
429 その他の腫瘍用薬(注射薬)
成
名
ダウノルビシン塩酸塩・シタラビン
分
新薬収載希望者
日本新薬(株)
販
売
名
(規格単位)
ビキセオス配合静注用((144mg)1瓶)
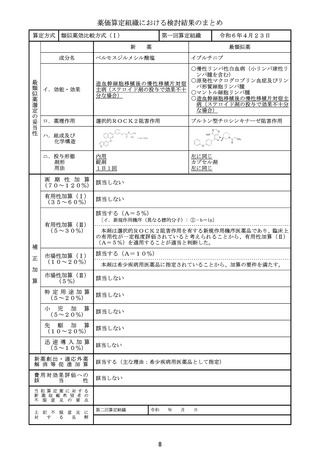
効 能 ・ 効 果
高リスク急性骨髄性白血病
主な用法・用量
寛解導入療法:
通常、本剤100ユニット(ダウノルビシン/シタラビンとして44mg/1
00mg)/m2(体表面積)を1日1回、90分かけて、最大2サイクルまで
投与する。1サイクル目として本剤を1、3、5日目に点滴静注する。1サイク
ル目に寛解に到達しなかった患者で、本剤への忍容性が良好な場合、1サイクル
目の投与開始から2~5週間後に、2サイクル目として本剤を1、3日目に点滴
静注する。
地固め療法:
通常、本剤65ユニット(ダウノルビシン/シタラビンとして29mg/6
5mg)/m2(体表面積)を1日1回、90分かけて、最大2サイクルまで投
与する。最後の寛解導入療法開始から5~8週間後に、1サイクル目として本剤
を1、3日目に点滴静注する。1サイクル目の投与開始後に病態が進行していな
い患者で、本剤への忍容性が良好な場合、1サイクル目の地固め療法開始から5
~8週間後に、2サイクル目として本剤を1、3日目に点滴静注する。
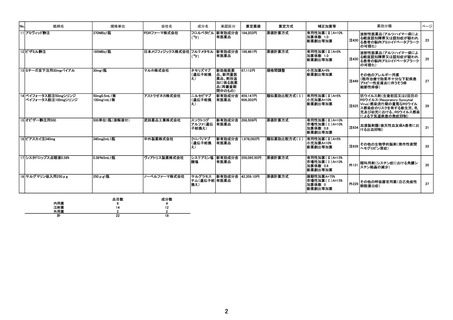
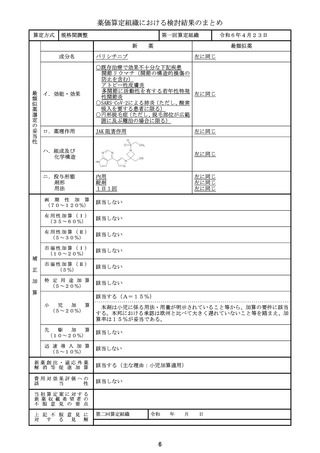
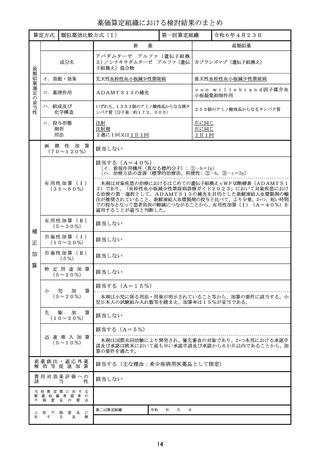
算 定 方 式
原価計算方式
製品総原価
原
618,921円
124,082円
営業利益
(流通経費を除く価格の16.7%)
価
算
計
55,067円
(消費税を除く価格の6.9%)
流通経費
算
出典:「医薬品産業実態調査報告書」(厚生労働省医政局医薬産業振興・医療情報企画課)
消 費
税
定
79,807円
補 正 加 算
有用性加算(Ⅰ)(A=45%)、市場性加算(Ⅰ)(A=10%)
加算係数 0
(加算前)
(加算後)
(144mg)1瓶
877,877円
→
877,877円
外 国 平 均
価 格 調 整
なし
算 定 薬
価
(144mg)1瓶
877,877円
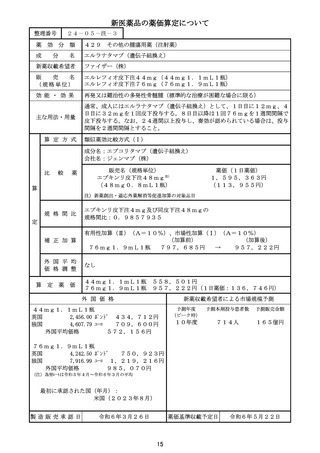
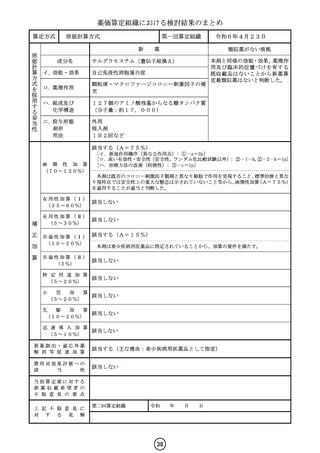
外 国 価 格
新薬収載希望者による市場規模予測
(144mg)1瓶
米国(ASP)
10,197.6 ドル 1,448,061円
英国
4,581.0 ポンド
810,837円
独国
7,779.6 ユーロ 1,198,054円
外国平均価格
1,152,317円
(参考)
米国(AWP)
予測年度
(ピーク時)
予測本剤投与患者数
予測販売金額
10年度
314人
20億円
最初に承認された国(年月):
米国(2017年8月)
12,240.0 ドル 1,738,080円
(注1)為替レートは令和5年4月~令和6年3月の平均
(注2)米国(AWP)は従来参照していた RED BOOK の価格
製造販売承認日
令和6年3月26日
薬価基準収載予定日
17
令和6年5月22日
整理番号
24-05-注-4
薬 効 分
類
429 その他の腫瘍用薬(注射薬)
成
名
ダウノルビシン塩酸塩・シタラビン
分
新薬収載希望者
日本新薬(株)
販
売
名
(規格単位)
ビキセオス配合静注用((144mg)1瓶)
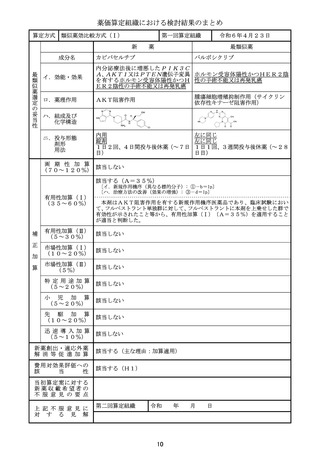
効 能 ・ 効 果
高リスク急性骨髄性白血病
主な用法・用量
寛解導入療法:
通常、本剤100ユニット(ダウノルビシン/シタラビンとして44mg/1
00mg)/m2(体表面積)を1日1回、90分かけて、最大2サイクルまで
投与する。1サイクル目として本剤を1、3、5日目に点滴静注する。1サイク
ル目に寛解に到達しなかった患者で、本剤への忍容性が良好な場合、1サイクル
目の投与開始から2~5週間後に、2サイクル目として本剤を1、3日目に点滴
静注する。
地固め療法:
通常、本剤65ユニット(ダウノルビシン/シタラビンとして29mg/6
5mg)/m2(体表面積)を1日1回、90分かけて、最大2サイクルまで投
与する。最後の寛解導入療法開始から5~8週間後に、1サイクル目として本剤
を1、3日目に点滴静注する。1サイクル目の投与開始後に病態が進行していな
い患者で、本剤への忍容性が良好な場合、1サイクル目の地固め療法開始から5
~8週間後に、2サイクル目として本剤を1、3日目に点滴静注する。
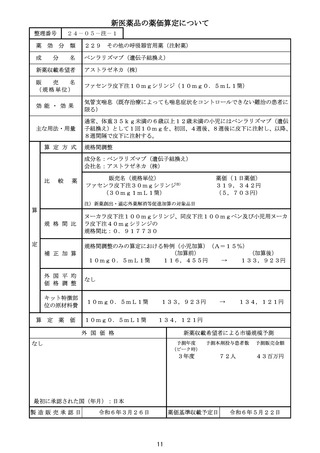
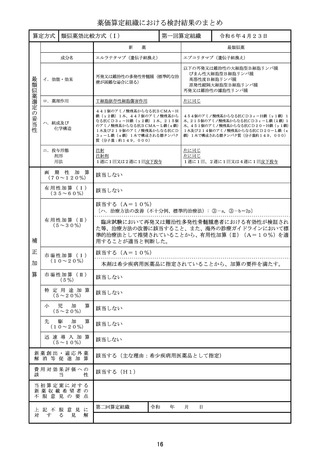
算 定 方 式
原価計算方式
製品総原価
原
618,921円
124,082円
営業利益
(流通経費を除く価格の16.7%)
価
算
計
55,067円
(消費税を除く価格の6.9%)
流通経費
算
出典:「医薬品産業実態調査報告書」(厚生労働省医政局医薬産業振興・医療情報企画課)
消 費
税
定
79,807円
補 正 加 算
有用性加算(Ⅰ)(A=45%)、市場性加算(Ⅰ)(A=10%)
加算係数 0
(加算前)
(加算後)
(144mg)1瓶
877,877円
→
877,877円
外 国 平 均
価 格 調 整
なし
算 定 薬
価
(144mg)1瓶
877,877円
外 国 価 格
新薬収載希望者による市場規模予測
(144mg)1瓶
米国(ASP)
10,197.6 ドル 1,448,061円
英国
4,581.0 ポンド
810,837円
独国
7,779.6 ユーロ 1,198,054円
外国平均価格
1,152,317円
(参考)
米国(AWP)
予測年度
(ピーク時)
予測本剤投与患者数
予測販売金額
10年度
314人
20億円
最初に承認された国(年月):
米国(2017年8月)
12,240.0 ドル 1,738,080円
(注1)為替レートは令和5年4月~令和6年3月の平均
(注2)米国(AWP)は従来参照していた RED BOOK の価格
製造販売承認日
令和6年3月26日
薬価基準収載予定日
17
令和6年5月22日