よむ、つかう、まなぶ。
【参考資料1】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について(参考資料).pdf (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
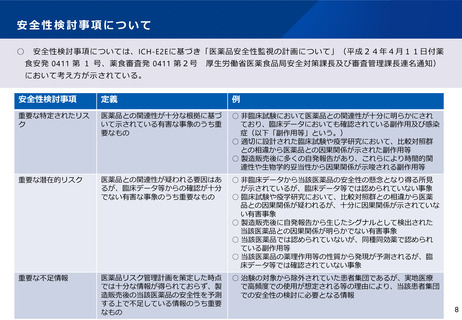
医薬品の市販後安全対策の概要 (情報収集・評価)
○ 医薬品の承認時の有効性・安全性等の評価は、患者数や患者背景(併用薬、年齢等)が限定された状況下
での治験等による限られた情報によるもの。
○ 市販後は、使用患者数が急増し、患者背景も多様化するため、承認時に判明しなかった副作用が顕在化す
ることがある。
→市販後に、医薬品の有効性・安全性等の情報の収集・評価が必要。
情報収集・評価の3つの基本的な柱
①副作用等報告制度<常に収集>
全ての医薬品について、製薬企業や医師、薬剤師等の医薬関係者から
副作用等が疑われる症例を収集し、随時評価(自発報告)。
必要な措置を実施
<市販直後調査>
新医薬品については、販売開始から6か月間、医療機関に対して、適正
な使用を繰り返し促すとともに、副作用等の情報収集体制を強化するこ
とを義務づけ。
②再審査<4~10年後に確認>
新医薬品について、市販後、使用の成績等の調査を求め、一定期間後
(通常8年後)に有効性・安全性を改めて確認。
評価
・
検討
・追加の注意喚起
・注意事項等情報の改訂
・承認事項の変更
・承認の取消し
等
③再評価<必要に応じ確認>
使用経験の長い医薬品について、現在の科学水準等に照らして、有効
性・安全性等を見直し。
3
○ 医薬品の承認時の有効性・安全性等の評価は、患者数や患者背景(併用薬、年齢等)が限定された状況下
での治験等による限られた情報によるもの。
○ 市販後は、使用患者数が急増し、患者背景も多様化するため、承認時に判明しなかった副作用が顕在化す
ることがある。
→市販後に、医薬品の有効性・安全性等の情報の収集・評価が必要。
情報収集・評価の3つの基本的な柱
①副作用等報告制度<常に収集>
全ての医薬品について、製薬企業や医師、薬剤師等の医薬関係者から
副作用等が疑われる症例を収集し、随時評価(自発報告)。
必要な措置を実施
<市販直後調査>
新医薬品については、販売開始から6か月間、医療機関に対して、適正
な使用を繰り返し促すとともに、副作用等の情報収集体制を強化するこ
とを義務づけ。
②再審査<4~10年後に確認>
新医薬品について、市販後、使用の成績等の調査を求め、一定期間後
(通常8年後)に有効性・安全性を改めて確認。
評価
・
検討
・追加の注意喚起
・注意事項等情報の改訂
・承認事項の変更
・承認の取消し
等
③再評価<必要に応じ確認>
使用経験の長い医薬品について、現在の科学水準等に照らして、有効
性・安全性等を見直し。
3