よむ、つかう、まなぶ。
【参考資料1】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について(参考資料).pdf (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年度第1回厚生科学審議会医薬品
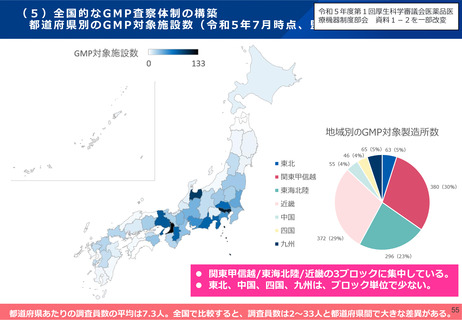
(5)全国的なGMP査察体制の構築
医療機器制度部会 資料1-2抜粋
薬事監視の観点からの上流問題(製造管理上の根本原因)への対応案
GE薬事業モデルの問題(取扱品目数の急増等)
行政のGMP/GQP課題
問題が重篤化する前に早期検
知できるよう、後発新規
GMP調査を強化
販売スケジュール・
企業のGMP/GQP課題
リソースが逼迫
人員体制の実態及び改善
状況をウォッチ
新規品目の技術検討の
時間がない、発売優先
・おざなりな工業化検討
・技術移転の形骸化等
製剤開発、工業化検討、
技術移転等の実態調査
堅牢性に乏しい工程・手
法で拙速に実生産開始
GMP調査(特に承認取得後
初回)の強化、OOS(規格
外試験結果)の監視強化
製造上の不具合が頻発
供給面での葛藤
法令違反 ※ ・隠蔽
問題解決力の向上のための
研修等
・法令遵守の啓発
・内部通報制度の設置
※承認書・手順等の不遵守
56
(5)全国的なGMP査察体制の構築
医療機器制度部会 資料1-2抜粋
薬事監視の観点からの上流問題(製造管理上の根本原因)への対応案
GE薬事業モデルの問題(取扱品目数の急増等)
行政のGMP/GQP課題
問題が重篤化する前に早期検
知できるよう、後発新規
GMP調査を強化
販売スケジュール・
企業のGMP/GQP課題
リソースが逼迫
人員体制の実態及び改善
状況をウォッチ
新規品目の技術検討の
時間がない、発売優先
・おざなりな工業化検討
・技術移転の形骸化等
製剤開発、工業化検討、
技術移転等の実態調査
堅牢性に乏しい工程・手
法で拙速に実生産開始
GMP調査(特に承認取得後
初回)の強化、OOS(規格
外試験結果)の監視強化
製造上の不具合が頻発
供給面での葛藤
法令違反 ※ ・隠蔽
問題解決力の向上のための
研修等
・法令遵守の啓発
・内部通報制度の設置
※承認書・手順等の不遵守
56