よむ、つかう、まなぶ。
【参考資料1】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について(参考資料).pdf (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
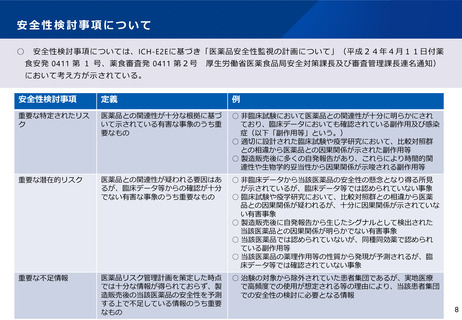
安全性検討事項について
○
安全性検討事項については、ICH-E2Eに基づき「医薬品安全性監視の計画について」(平成24年4月11日付薬
食安発 0411 第 1 号、薬食審査発 0411 第2号
厚生労働省医薬食品局安全対策課長及び審査管理課長連名通知)
において考え方が示されている。
安全性検討事項
定義
例
重要な特定されたリス
ク
医薬品との関連性が十分な根拠に基づ
いて示されている有害な事象のうち重
要なもの
○ 非臨床試験において医薬品との関連性が十分に明らかにされ
ており、臨床データにおいても確認されている副作用及び感染
症(以下「副作用等」という。)
○ 適切に設計された臨床試験や疫学研究において、比較対照群
との相違から医薬品との因果関係が示された副作用等
○ 製造販売後に多くの自発報告があり、これらにより時間的関
連性や生物学的妥当性から因果関係が示唆される副作用等
重要な潜在的リスク
医薬品との関連性が疑われる要因はあ
るが、臨床データ等からの確認が十分
でない有害な事象のうち重要なもの
○ 非臨床データから当該医薬品の安全性の懸念となり得る所見
が示されているが、臨床データ等では認められていない事象
○ 臨床試験や疫学研究において、比較対照群との相違から医薬
品との因果関係が疑われるが、十分に因果関係が示されていな
い有害事象
○ 製造販売後に自発報告から生じたシグナルとして検出された
当該医薬品との因果関係が明らかでない有害事象
○ 当該医薬品では認められていないが、同種同効薬で認められ
ている副作用等
○ 当該医薬品の薬理作用等の性質から発現が予測されるが、臨
床データ等では確認されていない事象
重要な不足情報
医薬品リスク管理計画を策定した時点
では十分な情報が得られておらず、製
造販売後の当該医薬品の安全性を予測
する上で不足している情報のうち重要
なもの
○ 治験の対象から除外されていた患者集団であるが、実地医療
で高頻度での使用が想定される等の理由により、当該患者集団
での安全性の検討に必要となる情報
8
○
安全性検討事項については、ICH-E2Eに基づき「医薬品安全性監視の計画について」(平成24年4月11日付薬
食安発 0411 第 1 号、薬食審査発 0411 第2号
厚生労働省医薬食品局安全対策課長及び審査管理課長連名通知)
において考え方が示されている。
安全性検討事項
定義
例
重要な特定されたリス
ク
医薬品との関連性が十分な根拠に基づ
いて示されている有害な事象のうち重
要なもの
○ 非臨床試験において医薬品との関連性が十分に明らかにされ
ており、臨床データにおいても確認されている副作用及び感染
症(以下「副作用等」という。)
○ 適切に設計された臨床試験や疫学研究において、比較対照群
との相違から医薬品との因果関係が示された副作用等
○ 製造販売後に多くの自発報告があり、これらにより時間的関
連性や生物学的妥当性から因果関係が示唆される副作用等
重要な潜在的リスク
医薬品との関連性が疑われる要因はあ
るが、臨床データ等からの確認が十分
でない有害な事象のうち重要なもの
○ 非臨床データから当該医薬品の安全性の懸念となり得る所見
が示されているが、臨床データ等では認められていない事象
○ 臨床試験や疫学研究において、比較対照群との相違から医薬
品との因果関係が疑われるが、十分に因果関係が示されていな
い有害事象
○ 製造販売後に自発報告から生じたシグナルとして検出された
当該医薬品との因果関係が明らかでない有害事象
○ 当該医薬品では認められていないが、同種同効薬で認められ
ている副作用等
○ 当該医薬品の薬理作用等の性質から発現が予測されるが、臨
床データ等では確認されていない事象
重要な不足情報
医薬品リスク管理計画を策定した時点
では十分な情報が得られておらず、製
造販売後の当該医薬品の安全性を予測
する上で不足している情報のうち重要
なもの
○ 治験の対象から除外されていた患者集団であるが、実地医療
で高頻度での使用が想定される等の理由により、当該患者集団
での安全性の検討に必要となる情報
8