よむ、つかう、まなぶ。
【参考資料1】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について(参考資料).pdf (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
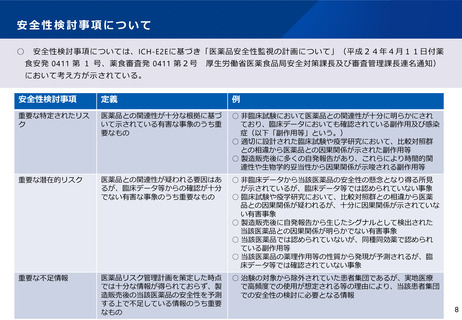
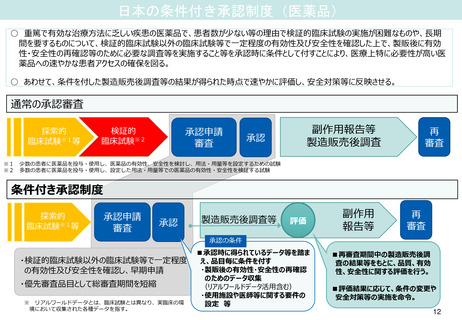
VigiBaseを活用した使用上の注意改訂事例
VigiBaseは個別症例安全性報告(ICSRs) を集めたWHOグローバルデータベース。1968年以降、WHO国際医薬品モニタリング制度加盟国から
報告された1500万件を超える副作用が疑われる症例が収められている。このデータも活用しながら、添付文書改訂等を検討している。
1.ナトリウム・グルコース共輸送体2(SGLT2)阻害剤含有製剤
改訂の理由及び
調査の結果
以下の点を踏まえ、専門委員の意見も踏まえた調査の結
果、外陰部及び会陰部の壊死性筋膜炎(フルニエ壊疽)
に関する注意喚起を追加することが適切と判断した。
• 国内において、SGLT2 阻害剤との因果関係が否定で
きない外陰部及び会陰部の壊死性筋膜炎(フルニエ
壊疽)を認めた症例が報告されていること
• 海外において、SGLT2 阻害剤服用後に当該事象を認
めた症例が集積していること
• WHO 個別症例安全性報告(ICSRs)グローバル
データベース(VigiBase)*を用いた不均衡分析に
おいて、複数のSGLT2 阻害剤(ダパグリフロジン、
カナグリフロジン、エンパグリフロジン)でフルニ
エ壊疽又は壊死性筋膜炎の副作用報告数が、データ
ベース全体から期待される値より高いことが統計学
的に示されているが、他の糖尿病用薬ではこのよう
な傾向は示されていないこと†。
• SGLT2 阻害剤投与時の外陰部及び会陰部の壊死性筋
膜炎(フルニエ壊疽)の発生機序は明確にはなって
いないものの、SGLT2 阻害剤の薬理作用(尿中グル
コース排泄促進作用)の影響も否定できないこと。
*:情報源は様々であり、疑われた副作用が医薬品と関連する可能性はすべて
の症例で同一ということではない。
†:WHO(世界保健機構)又はUMC(ウプサラモニタリングセンター)の見解
ではない。
2.HMG-CoA 還元酵素阻害薬を含有する医薬品
改訂の理由及び 重症筋無力症についての国内外の症例、公表文献、及び
調査の結果
国内外のガイドラインを評価した。専門委員の意見も聴
取した結果、以下の内容を踏まえ、使用上の注意を改訂
することが適切と判断した。
⚫
国内副作用症例において、HMG-CoA還元酵素阻害薬
(以下、「スタチン」)と重症筋無力症との因果関
係が否定できない症例注1が認められていること。
⚫
公表文献において、スタチンの再投与で重症筋無力
症の症状が再発した症例、スタチンの中止で重症筋
無力症の症状が消失した症例等、スタチンと重症筋
無力症との因果関係が否定できない示す症例が報告注
2されていること。
⚫
公表文献において、WHO個別症例安全性報告グロー
バルデータベース(VigiBase) 注3において不均衡分
析を行い、スタチンの重症筋無力症に関する副作用
報告数がデータベース全体から予測される値より統
計学的に有意に高かった(報告オッズ比[95%信頼
区間] = 2.66[2.28-3.10])との報告注4,注5がある
こと。また、機構で実施したVigiBaseの2023年5月
23日時点のデータセットを用いた不均衡分析におい
ても、同様の結果(重症筋無力症:IC025注 6= 0.9、眼
筋無力症:IC025 = 1.7)が示されたこと注4。
⚫
国内外のガイドライン 注7で、重症筋無力症において
注意を要する薬剤としてスタチンが記載されている
こと。
注1 : Medicine. 2015; 94: e416
注2 : Eur J Neurol. 2008; 15: e92-3、J Med Assoc Thai. 2011; 94: 256-8
注3:VigiBaseは、医薬品による副作用が疑われる症例が収められたWHO(世界保健機構)のグ
ローバルデータベースであり、UMC(ウプサラモニタリングセンター)により開発・維持
されている。情報源は様々であり、疑われた副作用が医薬品と関連する可能性はすべての
症例で同一ということではない。
30
注4:WHO又はUMCの見解ではない。 注5:Muscle & Nerve. 2019; 60: 382-6
VigiBaseは個別症例安全性報告(ICSRs) を集めたWHOグローバルデータベース。1968年以降、WHO国際医薬品モニタリング制度加盟国から
報告された1500万件を超える副作用が疑われる症例が収められている。このデータも活用しながら、添付文書改訂等を検討している。
1.ナトリウム・グルコース共輸送体2(SGLT2)阻害剤含有製剤
改訂の理由及び
調査の結果
以下の点を踏まえ、専門委員の意見も踏まえた調査の結
果、外陰部及び会陰部の壊死性筋膜炎(フルニエ壊疽)
に関する注意喚起を追加することが適切と判断した。
• 国内において、SGLT2 阻害剤との因果関係が否定で
きない外陰部及び会陰部の壊死性筋膜炎(フルニエ
壊疽)を認めた症例が報告されていること
• 海外において、SGLT2 阻害剤服用後に当該事象を認
めた症例が集積していること
• WHO 個別症例安全性報告(ICSRs)グローバル
データベース(VigiBase)*を用いた不均衡分析に
おいて、複数のSGLT2 阻害剤(ダパグリフロジン、
カナグリフロジン、エンパグリフロジン)でフルニ
エ壊疽又は壊死性筋膜炎の副作用報告数が、データ
ベース全体から期待される値より高いことが統計学
的に示されているが、他の糖尿病用薬ではこのよう
な傾向は示されていないこと†。
• SGLT2 阻害剤投与時の外陰部及び会陰部の壊死性筋
膜炎(フルニエ壊疽)の発生機序は明確にはなって
いないものの、SGLT2 阻害剤の薬理作用(尿中グル
コース排泄促進作用)の影響も否定できないこと。
*:情報源は様々であり、疑われた副作用が医薬品と関連する可能性はすべて
の症例で同一ということではない。
†:WHO(世界保健機構)又はUMC(ウプサラモニタリングセンター)の見解
ではない。
2.HMG-CoA 還元酵素阻害薬を含有する医薬品
改訂の理由及び 重症筋無力症についての国内外の症例、公表文献、及び
調査の結果
国内外のガイドラインを評価した。専門委員の意見も聴
取した結果、以下の内容を踏まえ、使用上の注意を改訂
することが適切と判断した。
⚫
国内副作用症例において、HMG-CoA還元酵素阻害薬
(以下、「スタチン」)と重症筋無力症との因果関
係が否定できない症例注1が認められていること。
⚫
公表文献において、スタチンの再投与で重症筋無力
症の症状が再発した症例、スタチンの中止で重症筋
無力症の症状が消失した症例等、スタチンと重症筋
無力症との因果関係が否定できない示す症例が報告注
2されていること。
⚫
公表文献において、WHO個別症例安全性報告グロー
バルデータベース(VigiBase) 注3において不均衡分
析を行い、スタチンの重症筋無力症に関する副作用
報告数がデータベース全体から予測される値より統
計学的に有意に高かった(報告オッズ比[95%信頼
区間] = 2.66[2.28-3.10])との報告注4,注5がある
こと。また、機構で実施したVigiBaseの2023年5月
23日時点のデータセットを用いた不均衡分析におい
ても、同様の結果(重症筋無力症:IC025注 6= 0.9、眼
筋無力症:IC025 = 1.7)が示されたこと注4。
⚫
国内外のガイドライン 注7で、重症筋無力症において
注意を要する薬剤としてスタチンが記載されている
こと。
注1 : Medicine. 2015; 94: e416
注2 : Eur J Neurol. 2008; 15: e92-3、J Med Assoc Thai. 2011; 94: 256-8
注3:VigiBaseは、医薬品による副作用が疑われる症例が収められたWHO(世界保健機構)のグ
ローバルデータベースであり、UMC(ウプサラモニタリングセンター)により開発・維持
されている。情報源は様々であり、疑われた副作用が医薬品と関連する可能性はすべての
症例で同一ということではない。
30
注4:WHO又はUMCの見解ではない。 注5:Muscle & Nerve. 2019; 60: 382-6