よむ、つかう、まなぶ。
【参考資料1】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について(参考資料).pdf (57 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年度第1回厚生科学審議会医薬品
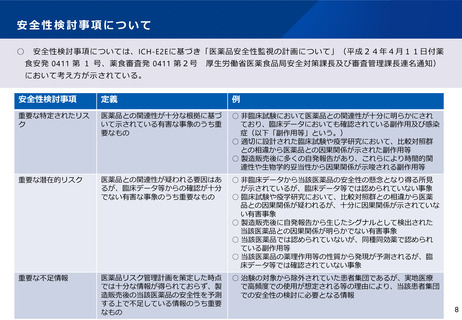
(5)全国的なGMP査察体制の構築
医療機器制度部会 資料1-2抜粋
現行の後発医薬品製造所に対する行政処分事案対応スキーム
許可業者
⓪
会社からの報告、内部通報等
②
立入検査
③
報告命令、報告書提出
④
弁明通知、処分通知
(②
立入検査)
①
事案報告・共有
都道府県
※以降、適宜状況
の共有
⓪ 会社からの報告、内部通報等
が、厚生労働省に寄せられること
もある
⑤ 情報の共有、業界としての
対策や取組みの報告・共有
厚生労働省
業界団体
57
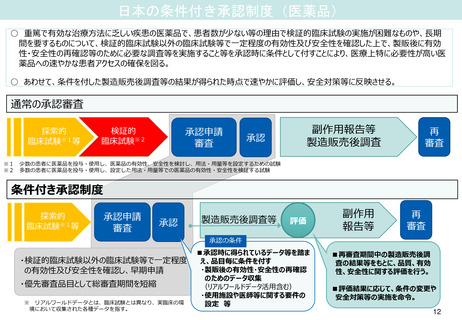
(5)全国的なGMP査察体制の構築
医療機器制度部会 資料1-2抜粋
現行の後発医薬品製造所に対する行政処分事案対応スキーム
許可業者
⓪
会社からの報告、内部通報等
②
立入検査
③
報告命令、報告書提出
④
弁明通知、処分通知
(②
立入検査)
①
事案報告・共有
都道府県
※以降、適宜状況
の共有
⓪ 会社からの報告、内部通報等
が、厚生労働省に寄せられること
もある
⑤ 情報の共有、業界としての
対策や取組みの報告・共有
厚生労働省
業界団体
57