よむ、つかう、まなぶ。
資料1-4 アセトアミノフェンの添付文書 (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34324.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会 医薬品等安全対策部会 安全対策調査会(令和5年度第4回 7/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 類似化合物(フェナセチン)の長期投与により、血色素異常
を起こすことがある。
15.1.2 腎盂及び膀胱腫瘍の患者を調査したところ、類似化合物(フェ
ナセチン)を長期・大量に使用(例:総服用量1.5~27kg、服用期
間4~30年)していた人が多いとの報告がある。
15.1.3 非ステロイド性消炎鎮痛剤を長期間投与されている女性にお
いて、一時的な不妊が認められたとの報告がある。
15.2 非臨床試験に基づく情報
類似化合物(フェナセチン)を長期・大量投与した動物実験で、腫
瘍発生が認められたとの報告がある。
表2:有効性判定結果
16. 薬物動態
18.2 解熱作用
無効
悪化
本剤群
(N=60)
著効
34
15
10
(56.7%) (81.7%) (98.3%)
有効
やや有効
1
0
オキシフェンブタゾン群
(N=60)
31
9
13
(51.7%) (66.7%) (88.3%)
7
0
U検定
N.S.
( ):累積%
両群ともに副作用は認められなかった5)。
18. 薬効薬理
18.1 作用機序
シクロオキシゲナーゼ阻害作用はほとんどなく、視床下部の体温調節中枢に
作用して皮膚血管を拡張させて体温を下げる。鎮痛作用は視床と大脳皮質の
痛覚閾値を高めることによると推定される3)。
18.2.1 38.0℃以上の発熱患児に本剤を投与し体温変化を検討した結果、体温
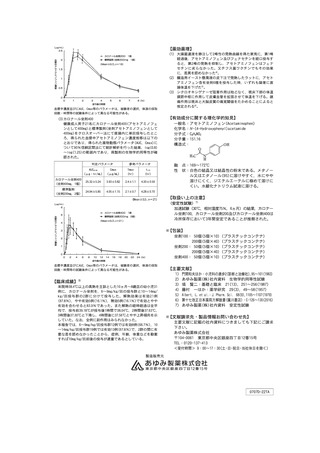
16.1 血中濃度
は投与後30分以内に下降し始め、1~2時間後にピークに達し4時間後まで効
健康成人10例に本剤(アセトアミノフェンとして400mg)を直腸内単回投与
したときの血漿中未変化体濃度は以下のとおりであった。
果が持続した6)。
直腸内単回投与時の血漿中未変化体濃度推移(平均値±標準誤差)
解熱曲線
直腸内単回投与時の薬物動態パラメータ
Cmax(μg/mL)
Tmax(hr)
AUC0~∞(μg・hr/mL)
T1/2(hr)
4.18±0.31
1.60±0.16
20.36±1.75
2.72±0.26
注)本剤の承認された用量は1回10~15mg/kgである。
18.2.2 腸チフス・パラチフスワクチンあるいはリポポリサッカライド発熱ウ
(平均値±標準誤差、n=10)
サギにおいて本剤(200mg)はスルピリン坐剤(200mg)、アスピリン坐剤
16.3 分布
(200mg)及びインドメタシン坐剤(50mg)とほぼ同等の解熱効果を示した。
16.3.1 ヒト9例にアセトアミノフェン1gを経口投与し、45分後に血液中及び血
なお、本剤(200mg)は正常体温に影響を及ぼさなかった7)。
漿中のアセトアミノフェン濃度を測定したところ、血液/血漿の濃度比は全
18.2.3 腸チフス・パラチフスワクチン発熱ウサギに対し、本剤32日間連続投
例でほぼ1(0.95~1.17)であった2)。
与後の解熱効果は単回投与時と変わらなかった7)。
16.3.2 イヌにアセトアミノフェン300mg/kgを経口投与したとき、投与2時間
19. 有効成分に関する理化学的知見
後におけるアセトアミノフェンの組織/血漿中濃度比は、ほとんどの組織で
一般的名称:アセトアミノフェン(Acetaminophen)
ほぼ1であった。また、脂肪においては他の組織より低い値であった 。
2)
化学名:N -(4-Hydroxyphenyl)acetamide
16.3.3 血漿蛋白結合率は25~30%であった3)。
分子式:C8H9NO2
16.4 代謝
分子量:151.16
グルクロン酸抱合及び硫酸抱合により代謝される。
性状:白色の結晶又は結晶性の粉末である。
16.5 排泄
メタノール又はエタノール(95)に溶けやすく、水にやや溶けにくく、ジエ
8ヵ月~6歳4ヵ月の健康な乳児、幼児及び小児に、本剤(アセトアミノフェ
チルエーテルに極めて溶けにくい。
ンとして1歳未満には50mg、1歳以上には100mg)を直腸内投与し、12時間尿
水酸化ナトリウム試液に溶ける。
中代謝パターンを検討したところ、未変化体の排泄率は0.9~2.7%であった。
化学構造式:
代謝物としてグルクロン酸抱合体が3.7~22.4%、硫酸抱合体が16.6~37.8%
排泄され、それらを含めた総アセトアミノフェン排泄量は尿全量が採取でき
た1歳以上の小児で63.5~68.1%であった。
17. 臨床成績
17.1 有効性及び安全性に関する試験
融点:169~172℃
17.1.1 国内第Ⅲ相試験(スルピリン坐剤との二重盲検比較試験)
20. 取扱い上の注意
38.5℃以上の発熱を有する小児患者132例を対象として本剤又はスルピリン坐
熱による基剤の溶融を避けるため、直射日光等を避けて冷所に保管すること。
剤を投与した。
有効性判定は下表のとおりであり、
本剤群が有意に優れていた。
表1:有効性判定結果
22. 包装
著効
有効
やや有効
無効
悪化
本剤群
(N=67)
38
16
9
(56.7%) (80.6%) (94.0%)
4
0
スルピリン群
(N=65)
25
14
18
(38.5%) (60.0%) (87.7%)
8
0
〈アンヒバ坐剤小児用50mg〉
U検定
50個[5個×10]
100個[5個×20箱]
P<0.05
〈アンヒバ坐剤小児用100mg〉
50個[5個×10]
( ):累積%
100個[5個×20箱]
両群ともに副作用は認められなかった4)。
〈アンヒバ坐剤小児用200mg〉
17.1.2 国内第Ⅲ相試験(オキシフェンブタゾン坐剤との二重盲検比較試験)
50個[5個×10]
38.0℃以上の発熱を有する小児患者120例を対象として本剤又はオキシフェ
ンブタゾン坐剤を投与した。有効性判定は下表のとおりであった。
100個[5個×20箱]
3
15.1 臨床使用に基づく情報
15.1.1 類似化合物(フェナセチン)の長期投与により、血色素異常
を起こすことがある。
15.1.2 腎盂及び膀胱腫瘍の患者を調査したところ、類似化合物(フェ
ナセチン)を長期・大量に使用(例:総服用量1.5~27kg、服用期
間4~30年)していた人が多いとの報告がある。
15.1.3 非ステロイド性消炎鎮痛剤を長期間投与されている女性にお
いて、一時的な不妊が認められたとの報告がある。
15.2 非臨床試験に基づく情報
類似化合物(フェナセチン)を長期・大量投与した動物実験で、腫
瘍発生が認められたとの報告がある。
表2:有効性判定結果
16. 薬物動態
18.2 解熱作用
無効
悪化
本剤群
(N=60)
著効
34
15
10
(56.7%) (81.7%) (98.3%)
有効
やや有効
1
0
オキシフェンブタゾン群
(N=60)
31
9
13
(51.7%) (66.7%) (88.3%)
7
0
U検定
N.S.
( ):累積%
両群ともに副作用は認められなかった5)。
18. 薬効薬理
18.1 作用機序
シクロオキシゲナーゼ阻害作用はほとんどなく、視床下部の体温調節中枢に
作用して皮膚血管を拡張させて体温を下げる。鎮痛作用は視床と大脳皮質の
痛覚閾値を高めることによると推定される3)。
18.2.1 38.0℃以上の発熱患児に本剤を投与し体温変化を検討した結果、体温
16.1 血中濃度
は投与後30分以内に下降し始め、1~2時間後にピークに達し4時間後まで効
健康成人10例に本剤(アセトアミノフェンとして400mg)を直腸内単回投与
したときの血漿中未変化体濃度は以下のとおりであった。
果が持続した6)。
直腸内単回投与時の血漿中未変化体濃度推移(平均値±標準誤差)
解熱曲線
直腸内単回投与時の薬物動態パラメータ
Cmax(μg/mL)
Tmax(hr)
AUC0~∞(μg・hr/mL)
T1/2(hr)
4.18±0.31
1.60±0.16
20.36±1.75
2.72±0.26
注)本剤の承認された用量は1回10~15mg/kgである。
18.2.2 腸チフス・パラチフスワクチンあるいはリポポリサッカライド発熱ウ
(平均値±標準誤差、n=10)
サギにおいて本剤(200mg)はスルピリン坐剤(200mg)、アスピリン坐剤
16.3 分布
(200mg)及びインドメタシン坐剤(50mg)とほぼ同等の解熱効果を示した。
16.3.1 ヒト9例にアセトアミノフェン1gを経口投与し、45分後に血液中及び血
なお、本剤(200mg)は正常体温に影響を及ぼさなかった7)。
漿中のアセトアミノフェン濃度を測定したところ、血液/血漿の濃度比は全
18.2.3 腸チフス・パラチフスワクチン発熱ウサギに対し、本剤32日間連続投
例でほぼ1(0.95~1.17)であった2)。
与後の解熱効果は単回投与時と変わらなかった7)。
16.3.2 イヌにアセトアミノフェン300mg/kgを経口投与したとき、投与2時間
19. 有効成分に関する理化学的知見
後におけるアセトアミノフェンの組織/血漿中濃度比は、ほとんどの組織で
一般的名称:アセトアミノフェン(Acetaminophen)
ほぼ1であった。また、脂肪においては他の組織より低い値であった 。
2)
化学名:N -(4-Hydroxyphenyl)acetamide
16.3.3 血漿蛋白結合率は25~30%であった3)。
分子式:C8H9NO2
16.4 代謝
分子量:151.16
グルクロン酸抱合及び硫酸抱合により代謝される。
性状:白色の結晶又は結晶性の粉末である。
16.5 排泄
メタノール又はエタノール(95)に溶けやすく、水にやや溶けにくく、ジエ
8ヵ月~6歳4ヵ月の健康な乳児、幼児及び小児に、本剤(アセトアミノフェ
チルエーテルに極めて溶けにくい。
ンとして1歳未満には50mg、1歳以上には100mg)を直腸内投与し、12時間尿
水酸化ナトリウム試液に溶ける。
中代謝パターンを検討したところ、未変化体の排泄率は0.9~2.7%であった。
化学構造式:
代謝物としてグルクロン酸抱合体が3.7~22.4%、硫酸抱合体が16.6~37.8%
排泄され、それらを含めた総アセトアミノフェン排泄量は尿全量が採取でき
た1歳以上の小児で63.5~68.1%であった。
17. 臨床成績
17.1 有効性及び安全性に関する試験
融点:169~172℃
17.1.1 国内第Ⅲ相試験(スルピリン坐剤との二重盲検比較試験)
20. 取扱い上の注意
38.5℃以上の発熱を有する小児患者132例を対象として本剤又はスルピリン坐
熱による基剤の溶融を避けるため、直射日光等を避けて冷所に保管すること。
剤を投与した。
有効性判定は下表のとおりであり、
本剤群が有意に優れていた。
表1:有効性判定結果
22. 包装
著効
有効
やや有効
無効
悪化
本剤群
(N=67)
38
16
9
(56.7%) (80.6%) (94.0%)
4
0
スルピリン群
(N=65)
25
14
18
(38.5%) (60.0%) (87.7%)
8
0
〈アンヒバ坐剤小児用50mg〉
U検定
50個[5個×10]
100個[5個×20箱]
P<0.05
〈アンヒバ坐剤小児用100mg〉
50個[5個×10]
( ):累積%
100個[5個×20箱]
両群ともに副作用は認められなかった4)。
〈アンヒバ坐剤小児用200mg〉
17.1.2 国内第Ⅲ相試験(オキシフェンブタゾン坐剤との二重盲検比較試験)
50個[5個×10]
38.0℃以上の発熱を有する小児患者120例を対象として本剤又はオキシフェ
ンブタゾン坐剤を投与した。有効性判定は下表のとおりであった。
100個[5個×20箱]
3