よむ、つかう、まなぶ。
資料1-4 アセトアミノフェンの添付文書 (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34324.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会 医薬品等安全対策部会 安全対策調査会(令和5年度第4回 7/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
14. 適用上の注意
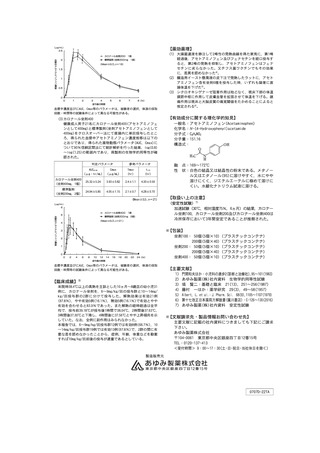
血漿中アセトアミノフェン濃度推移(平均値+標準偏差)
(μg/mL)
50
血漿中アセトアミノフェン濃度
14.1 薬剤投与前の注意
14.1.1 低温下では、結晶析出の可能性がある。結晶が析出した場
合は、湯煎(60℃以下)にて加温溶解後、放冷して使用するこ
と。
14.2 薬剤投与時の注意
14.2.1 針は、ゴム栓の刻印部(〇印)に垂直にゆっくり刺すこと。
斜めに刺した場合、削り片の混入及び液漏れの原因となるおそれ
がある。また、針は同一箇所に繰り返し刺さないこと。
14.2.2 本剤への他剤の混注は行わないこと。
14.2.3 容器の目盛りは目安として使用すること。
14.2.4 残液は使用しないこと。
40
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1) 日本人健康成人男性に本剤30、65、100mL(アセトアミノ
フェンとして300、650、1000mg)をいずれも15分かけて静
脈内投与したとき、血漿中アセトアミノフェン濃度推移及び薬
物動態パラメータは以下に示すとおりであった。用量にかかわ
らず、血漿中濃度は投与終了直後にCmaxに達した後、約2.5時
間のt1/2で低下した。300mgから1000mgの用量範囲で、血漿
中アセトアミノフェン濃度のC max 及びAUCは用量に比例して
増加し、線形性が認められた2)。
10
血漿中アセトアミノフェン濃度
2
4
6
8
12 (hr)
10
血漿中アセトアミノフェンの薬物動態パラメータ
例
数
投与薬剤
平均値(標準偏差)
Cmax
AUC0-t
(μg・hr/mL) (μg/mL)
t1/2
(hr)
CL
(L/hr/kg)
tmax
(hr)
アセトアミノフェン静注液
19 60.01(8.66) 43.01(6.62) 2.72(0.38) 0.256(0.037) 0.25(0.0 )
(1000mg、1バイアル)
アセトアミノフェン錠
20 53.62(9.87) 23.56(8.51) 2.78(0.47) 0.285(0.051) 0.49(0.24)
(200mg、5錠)
(3) 本剤を小児には1.5mL/kg(アセトアミノフェンとして15mg/
kg)及び成人には100mL(アセトアミノフェンとして
1000mg)を単回静脈内投与した際の薬物動態パラメータの推
定値を以下に要約する(外国人データ) 4)。幼児及び青年にお
けるAUCは成人と同程度であるが、新生児及び乳児では成人よ
り大きい。生後1カ月以上2歳未満の乳児及び28日齢までの新生
児においては、用量をそれぞれ33%及び50%減量し、投与間隔
を6時間以上空けることにより、2歳以上の小児と同様のAUC
が得られることが、乳児及び新生児の薬物動態データに基づい
た用量シミュレーションにより示されている注)。
平均値(標準偏差)
新生児
62(11)
25( 4)
乳 児
57(54)
29(24) 4.2(2.9) 0.29(0.15) 1.1(0.3)
幼 児
38( 8)
29( 7)
3.0(1.5) 0.34(0.10) 1.2(0.3)
アセトアミノフェン静注液 1000mg
青 年
41( 7)
31( 9)
2.9(0.7) 0.29(0.08) 1.1(0.3)
アセトアミノフェン静注液
650mg
成 人
43(11)
28(21) 2.4(0.6) 0.27(0.08) 0.8(0.2)
アセトアミノフェン静注液
300mg
8
10
CL
(L/hr/kg)
12 (hr)
tmax
(hr)
300mg
17.38( 1.87) 11.06(1.37) 2.79(0.28) 0.238(0.033) 0.25(0.0)
650mg
44.29( 4.15) 22.35(5.72) 2.83(0.37) 0.212(0.029) 0.25(0.0)
1000mg
59.72(10.83) 46.17(5.93) 2.59(0.20) 0.253(0.042) 0.25(0.0)
CL
(L/hr/kg)
Vss
(L/kg)
7.0(2.7) 0.12(0.04) 1.1(0.2)
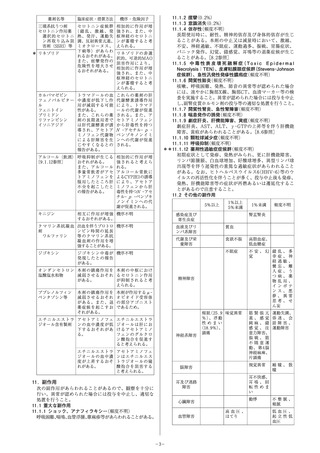
16.1.2 反復投与
日本人健康成人男性に本剤65mL(アセトアミノフェンとして
650mg)を1日6回(4時間毎)2日間反復静脈内投与(投与速度
65mL/15分)又は本剤100mL(アセトアミノフェンとして
1000mg)を1日4回(6時間毎)2日間反復静脈内投与(投与速
度100mL/15分)したときの薬物動態パラメータは以下に示すと
おりであった。いずれも反復投与開始後12時間までに定常状態
に達し、蓄積性は認められなかった2)。
血漿中アセトアミノフェンの薬物動態パラメータ
平均値(標準偏差)
、例数=8
t1/2
(hr)
t1/2
(hr)
注)乳児及び2歳未満の幼児における用法・用量は以下のとおりである。
通常、乳児及び2歳未満の幼児にはアセトアミノフェンとして、体重1kgあ
たり1回7.5mgを15分かけて静脈内投与し、投与間隔は4~6時間以上とす
る。なお、年齢、症状により適宜増減するが、1日総量として30mg/kgを
限度とする。
血漿中アセトアミノフェンの薬物動態パラメータ
Cmax
AUC0-t
(μg・hr/mL) (μg/mL)
4
Cmax
AUC
(μg・hr/mL) (μg/mL)
6
投与後時間
用量
2
サブ集団
20
0
0
投与後時間
血漿中アセトアミノフェン濃度推移(平均値+標準偏差)
40
1000mg
20
0
15.1 臨床使用に基づく情報
15.1.1 類似化合物(フェナセチン)の長期投与により、血色素異
常を起こすことがある。
15.1.2 腎盂及び膀胱腫瘍の患者を調査したところ、類似化合物
(フェナセチン)製剤を長期・大量に使用(例:総服用量1.5~
27kg、服用期間4~30年)していた人が多いとの報告がある。
15.1.3 非ステロイド性消炎鎮痛剤を長期間投与されている女性に
おいて、一時的な不妊が認められたとの報告がある。
15.2 非臨床使用に基づく情報
類似化合物(フェナセチン)を長期・大量投与した動物実験で、
腫瘍発生が認められたとの報告がある。
0
アセトアミノフェン錠
30
15. その他の注意
(μg/mL)
60
アセトアミノフェン静注液 1000mg
用量
(2) 日本人健康成人男性に本剤100mLと経口製剤(いずれもアセ
トアミノフェンとして1000mg)をクロスオーバー法により単
回投与(本剤の投与速度100mL/15分)したとき、血漿中アセ
トアミノフェン濃度推移及び薬物動態パラメータは以下に示す
とおりであった。Cmaxの増加、tmaxの短縮はあったが投与後30
分以降の血漿中濃度は経口製剤と同様の推移を示し、AUCや
t1/2、尿中代謝物プロファイル等その他薬物動態パラメータに投
与経路による違いは認められなかった3)。
650mg
1000mg
投与
(回)
平均値(標準偏差)
、例数=8
Cmax
AUCτ
(μg・hr/mL) (μg/mL)
t1/2
(hr)
CL
(L/hr/kg)
tmax
(hr)
1
30.66( 4.62) 31.22(1.95) 2.53(0.32) 0.244(0.033) 0.25(0.0)
12
44.34( 6.42) 32.47(3.47) 2.61(0.21) 0.241(0.021) 0.25(0.0)
1
52.35( 5.77) 42.05(7.13) 2.39(0.14) 0.274(0.035) 0.25(0.0)
8
64.37(11.31) 49.23(5.28) 2.65(0.32) 0.268(0.038) 0.25(0.0)
16.3 分布
16.3.1 アセトアミノフェンの血漿蛋白結合率は低く、血漿中濃度
60μg/mLまでは結合はみられず、血漿中濃度280μg/mLにお
いても約20%であった(外国人データ)5)。
16.3.2 妊娠した女性を対象とした試験で、アセトアミノフェンの
- 3 -
血漿中アセトアミノフェン濃度推移(平均値+標準偏差)
(μg/mL)
50
血漿中アセトアミノフェン濃度
14.1 薬剤投与前の注意
14.1.1 低温下では、結晶析出の可能性がある。結晶が析出した場
合は、湯煎(60℃以下)にて加温溶解後、放冷して使用するこ
と。
14.2 薬剤投与時の注意
14.2.1 針は、ゴム栓の刻印部(〇印)に垂直にゆっくり刺すこと。
斜めに刺した場合、削り片の混入及び液漏れの原因となるおそれ
がある。また、針は同一箇所に繰り返し刺さないこと。
14.2.2 本剤への他剤の混注は行わないこと。
14.2.3 容器の目盛りは目安として使用すること。
14.2.4 残液は使用しないこと。
40
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1) 日本人健康成人男性に本剤30、65、100mL(アセトアミノ
フェンとして300、650、1000mg)をいずれも15分かけて静
脈内投与したとき、血漿中アセトアミノフェン濃度推移及び薬
物動態パラメータは以下に示すとおりであった。用量にかかわ
らず、血漿中濃度は投与終了直後にCmaxに達した後、約2.5時
間のt1/2で低下した。300mgから1000mgの用量範囲で、血漿
中アセトアミノフェン濃度のC max 及びAUCは用量に比例して
増加し、線形性が認められた2)。
10
血漿中アセトアミノフェン濃度
2
4
6
8
12 (hr)
10
血漿中アセトアミノフェンの薬物動態パラメータ
例
数
投与薬剤
平均値(標準偏差)
Cmax
AUC0-t
(μg・hr/mL) (μg/mL)
t1/2
(hr)
CL
(L/hr/kg)
tmax
(hr)
アセトアミノフェン静注液
19 60.01(8.66) 43.01(6.62) 2.72(0.38) 0.256(0.037) 0.25(0.0 )
(1000mg、1バイアル)
アセトアミノフェン錠
20 53.62(9.87) 23.56(8.51) 2.78(0.47) 0.285(0.051) 0.49(0.24)
(200mg、5錠)
(3) 本剤を小児には1.5mL/kg(アセトアミノフェンとして15mg/
kg)及び成人には100mL(アセトアミノフェンとして
1000mg)を単回静脈内投与した際の薬物動態パラメータの推
定値を以下に要約する(外国人データ) 4)。幼児及び青年にお
けるAUCは成人と同程度であるが、新生児及び乳児では成人よ
り大きい。生後1カ月以上2歳未満の乳児及び28日齢までの新生
児においては、用量をそれぞれ33%及び50%減量し、投与間隔
を6時間以上空けることにより、2歳以上の小児と同様のAUC
が得られることが、乳児及び新生児の薬物動態データに基づい
た用量シミュレーションにより示されている注)。
平均値(標準偏差)
新生児
62(11)
25( 4)
乳 児
57(54)
29(24) 4.2(2.9) 0.29(0.15) 1.1(0.3)
幼 児
38( 8)
29( 7)
3.0(1.5) 0.34(0.10) 1.2(0.3)
アセトアミノフェン静注液 1000mg
青 年
41( 7)
31( 9)
2.9(0.7) 0.29(0.08) 1.1(0.3)
アセトアミノフェン静注液
650mg
成 人
43(11)
28(21) 2.4(0.6) 0.27(0.08) 0.8(0.2)
アセトアミノフェン静注液
300mg
8
10
CL
(L/hr/kg)
12 (hr)
tmax
(hr)
300mg
17.38( 1.87) 11.06(1.37) 2.79(0.28) 0.238(0.033) 0.25(0.0)
650mg
44.29( 4.15) 22.35(5.72) 2.83(0.37) 0.212(0.029) 0.25(0.0)
1000mg
59.72(10.83) 46.17(5.93) 2.59(0.20) 0.253(0.042) 0.25(0.0)
CL
(L/hr/kg)
Vss
(L/kg)
7.0(2.7) 0.12(0.04) 1.1(0.2)
16.1.2 反復投与
日本人健康成人男性に本剤65mL(アセトアミノフェンとして
650mg)を1日6回(4時間毎)2日間反復静脈内投与(投与速度
65mL/15分)又は本剤100mL(アセトアミノフェンとして
1000mg)を1日4回(6時間毎)2日間反復静脈内投与(投与速
度100mL/15分)したときの薬物動態パラメータは以下に示すと
おりであった。いずれも反復投与開始後12時間までに定常状態
に達し、蓄積性は認められなかった2)。
血漿中アセトアミノフェンの薬物動態パラメータ
平均値(標準偏差)
、例数=8
t1/2
(hr)
t1/2
(hr)
注)乳児及び2歳未満の幼児における用法・用量は以下のとおりである。
通常、乳児及び2歳未満の幼児にはアセトアミノフェンとして、体重1kgあ
たり1回7.5mgを15分かけて静脈内投与し、投与間隔は4~6時間以上とす
る。なお、年齢、症状により適宜増減するが、1日総量として30mg/kgを
限度とする。
血漿中アセトアミノフェンの薬物動態パラメータ
Cmax
AUC0-t
(μg・hr/mL) (μg/mL)
4
Cmax
AUC
(μg・hr/mL) (μg/mL)
6
投与後時間
用量
2
サブ集団
20
0
0
投与後時間
血漿中アセトアミノフェン濃度推移(平均値+標準偏差)
40
1000mg
20
0
15.1 臨床使用に基づく情報
15.1.1 類似化合物(フェナセチン)の長期投与により、血色素異
常を起こすことがある。
15.1.2 腎盂及び膀胱腫瘍の患者を調査したところ、類似化合物
(フェナセチン)製剤を長期・大量に使用(例:総服用量1.5~
27kg、服用期間4~30年)していた人が多いとの報告がある。
15.1.3 非ステロイド性消炎鎮痛剤を長期間投与されている女性に
おいて、一時的な不妊が認められたとの報告がある。
15.2 非臨床使用に基づく情報
類似化合物(フェナセチン)を長期・大量投与した動物実験で、
腫瘍発生が認められたとの報告がある。
0
アセトアミノフェン錠
30
15. その他の注意
(μg/mL)
60
アセトアミノフェン静注液 1000mg
用量
(2) 日本人健康成人男性に本剤100mLと経口製剤(いずれもアセ
トアミノフェンとして1000mg)をクロスオーバー法により単
回投与(本剤の投与速度100mL/15分)したとき、血漿中アセ
トアミノフェン濃度推移及び薬物動態パラメータは以下に示す
とおりであった。Cmaxの増加、tmaxの短縮はあったが投与後30
分以降の血漿中濃度は経口製剤と同様の推移を示し、AUCや
t1/2、尿中代謝物プロファイル等その他薬物動態パラメータに投
与経路による違いは認められなかった3)。
650mg
1000mg
投与
(回)
平均値(標準偏差)
、例数=8
Cmax
AUCτ
(μg・hr/mL) (μg/mL)
t1/2
(hr)
CL
(L/hr/kg)
tmax
(hr)
1
30.66( 4.62) 31.22(1.95) 2.53(0.32) 0.244(0.033) 0.25(0.0)
12
44.34( 6.42) 32.47(3.47) 2.61(0.21) 0.241(0.021) 0.25(0.0)
1
52.35( 5.77) 42.05(7.13) 2.39(0.14) 0.274(0.035) 0.25(0.0)
8
64.37(11.31) 49.23(5.28) 2.65(0.32) 0.268(0.038) 0.25(0.0)
16.3 分布
16.3.1 アセトアミノフェンの血漿蛋白結合率は低く、血漿中濃度
60μg/mLまでは結合はみられず、血漿中濃度280μg/mLにお
いても約20%であった(外国人データ)5)。
16.3.2 妊娠した女性を対象とした試験で、アセトアミノフェンの
- 3 -