よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
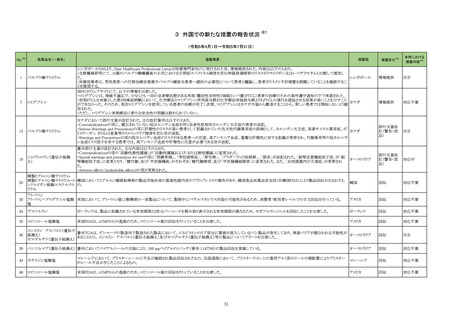
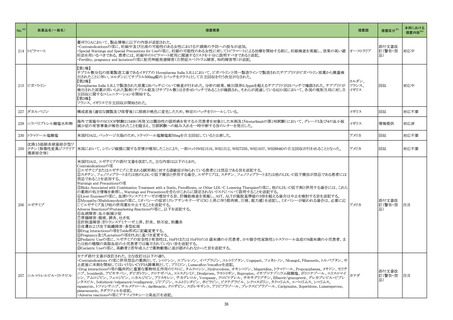
No.※2
一般名
薬効
分類
改訂内容
改訂理由
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
改訂案
8. 重要な基本的注意
8. 重要な基本的注意
本剤によるショック、アナフィラキシーの発生を確実に予知できる方
本剤によるショック、アナフィラキシー、アレルギー反応に伴う急性
法がないので、次の措置をとること。
冠症候群の発生を確実に予知できる方法がないので、次の措置を
とること。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
アレルギー反応に伴う急性冠症候群
令和5年 10 月 12 日発出
フィルグラスチム
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
(遺伝子組換え)
現行
フィルグラスチム
重要な基本的注意
(新設)
(遺伝子組換え)
[フィルグラスチム
23-21
後続1]
フィルグラスチム
339 そ
の他の
血液・体
液用薬
(遺伝子組換え)
[フィルグラスチム
改訂案
重要な基本的注意
がん化学療法による好中球減少症に対する注意
海外観察研究において、がん化学療法(単独又は放射線療法と
の併用)とともにペグフィルグラスチム(遺伝子組換え)又はフィル
グラスチム(遺伝子組換え)が使用された乳癌又は肺癌患者で
は骨髄異形成症候群又は急性骨髄性白血病のリスクが増加し
たとの報告がある。本剤と骨髄異形成症候群又は急性骨髄性白
血病の因果関係は明らかではないが、本剤の投与後は患者の
状態を十分に観察すること。
後続2]
【参考】Danese,M.D.,et al.:Adv.Ther. 2022;39:2778-2795
13
海外レトロスペクティブコホート研究(Adv Ther. 2022; 39: 2778-95、以
下、「本研究」)において、がん化学療法(単独又は放射線療法との併
用)とともにペグフィルグラスチム(遺伝子組換え)又はフィルグラスチ
ム(遺伝子組換え)が使用された乳癌又は肺癌患者では骨髄異形成症
候群又は急性骨髄性白血病(以下、「MDS/AML」)のリスクが増加する
ことが示唆された。なお、本研究では、がん化学療法及び放射線療法
の累積投与量の把握が困難であり、顆粒球コロニー形成刺激因子製
剤(以下、「G-CSF 製剤」)が投与された患者では、MDS/AML 発現の
リスク因子とされているがん化学療法及び放射線療法の使用量が多
い可能性があること等の研究上の限界がある。また、本研究結果とは
異なり、G-CSF 製剤において統計学的に有意な MDS/AML のリスク
増加が認められていない報告もある(Int J Cancer. 2021; 148: 375-84
等)。
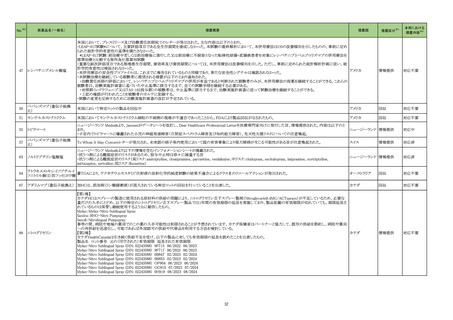
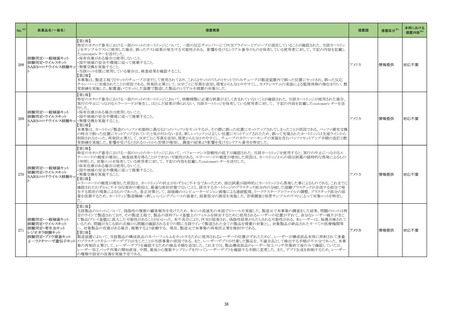
一般名
薬効
分類
改訂内容
改訂理由
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
改訂案
8. 重要な基本的注意
8. 重要な基本的注意
本剤によるショック、アナフィラキシーの発生を確実に予知できる方
本剤によるショック、アナフィラキシー、アレルギー反応に伴う急性
法がないので、次の措置をとること。
冠症候群の発生を確実に予知できる方法がないので、次の措置を
とること。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
アレルギー反応に伴う急性冠症候群
令和5年 10 月 12 日発出
フィルグラスチム
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
(遺伝子組換え)
現行
フィルグラスチム
重要な基本的注意
(新設)
(遺伝子組換え)
[フィルグラスチム
23-21
後続1]
フィルグラスチム
339 そ
の他の
血液・体
液用薬
(遺伝子組換え)
[フィルグラスチム
改訂案
重要な基本的注意
がん化学療法による好中球減少症に対する注意
海外観察研究において、がん化学療法(単独又は放射線療法と
の併用)とともにペグフィルグラスチム(遺伝子組換え)又はフィル
グラスチム(遺伝子組換え)が使用された乳癌又は肺癌患者で
は骨髄異形成症候群又は急性骨髄性白血病のリスクが増加し
たとの報告がある。本剤と骨髄異形成症候群又は急性骨髄性白
血病の因果関係は明らかではないが、本剤の投与後は患者の
状態を十分に観察すること。
後続2]
【参考】Danese,M.D.,et al.:Adv.Ther. 2022;39:2778-2795
13
海外レトロスペクティブコホート研究(Adv Ther. 2022; 39: 2778-95、以
下、「本研究」)において、がん化学療法(単独又は放射線療法との併
用)とともにペグフィルグラスチム(遺伝子組換え)又はフィルグラスチ
ム(遺伝子組換え)が使用された乳癌又は肺癌患者では骨髄異形成症
候群又は急性骨髄性白血病(以下、「MDS/AML」)のリスクが増加する
ことが示唆された。なお、本研究では、がん化学療法及び放射線療法
の累積投与量の把握が困難であり、顆粒球コロニー形成刺激因子製
剤(以下、「G-CSF 製剤」)が投与された患者では、MDS/AML 発現の
リスク因子とされているがん化学療法及び放射線療法の使用量が多
い可能性があること等の研究上の限界がある。また、本研究結果とは
異なり、G-CSF 製剤において統計学的に有意な MDS/AML のリスク
増加が認められていない報告もある(Int J Cancer. 2021; 148: 375-84
等)。