よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
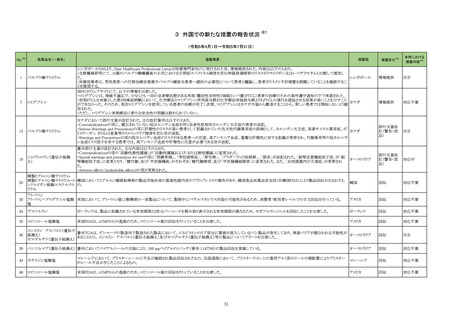
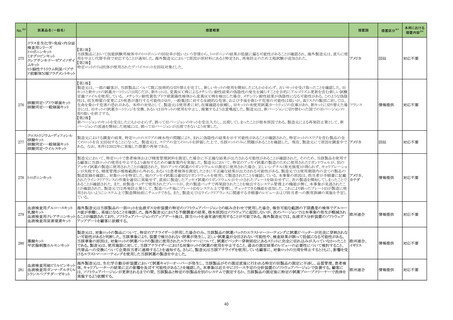
No.※2
一般名
薬効
分類
改訂内容
改訂理由
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
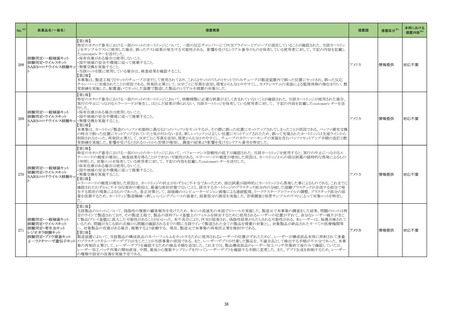
23-38
ガラクトシル人血
清アルブミンジエ
チレントリアミン五
酢酸テクネチウム
(99mTc)
現行
430
放射性
医薬品
改訂案
(新設)
2. 禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
11. 副作用
(新設)
11. 副作用
11.1 重大な副作用
ショック、アナフィラキシー
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
アナフィラキシー関連症例を評
価した。症例の因果関係評価及
び使用上の注意の改訂要否に
ついて、専門委員の意見も聴取
した結果、本剤とショック及びア
ナフィラキシーとの因果関係の
否定できない症例が集積したこ
とから、使用上の注意を改訂す
ることが適切と判断した。
アナフィラキシー関連症例*の国内
症例の集積状況
医薬品の品質、有効性及び安全
性に関する情報の収集、調査、
検討等を踏まえ、医薬品の「使
用上の注意」の改訂が必要と考
えた。
-
4 例(うち、医薬品と事象との因果
関係が否定できない症例 4 例)
【死亡 0 例】
*:医薬品医療機器総合機構に
おける副作用等報告データベー
スに登録された症例
令和5年 11 月 24 日発出
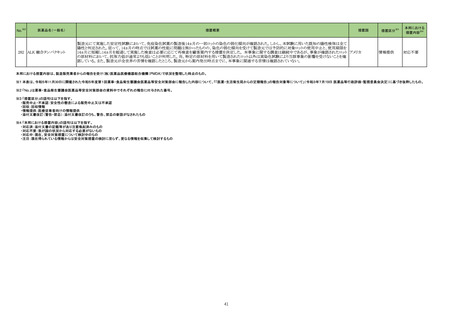
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
7. 用法及び用量に関連する注意
〈切除不能な進行・再発の非小細胞肺癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤
は、「17.臨床成績」の項の内容を熟知し、臨床試験において検討さ
れた患者の PD-L1 発現率を考慮した上で選択すること。
23-39
ニボルマブ(遺伝
子組換え)
429 そ
の他の
腫瘍用
薬
改訂案
7. 用法及び用量に関連する注意
〈切除不能な進行・再発の非小細胞肺癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤
は、「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライ
ン等を参考にした上で、臨床試験において検討された患者の PD-L1
発現率を考慮した上で選択すること。
〈非小細胞肺癌における術前補助療法〉
併用する他の抗悪性腫瘍剤は、「17.臨床成績」の項の内容を熟知し
選択すること。
〈非小細胞肺癌における術前補助療法〉
併用する他の抗悪性腫瘍剤は、「17.臨床成績」の項の内容を熟知
し、国内外の最新のガイドライン等を参考にした上で、選択すること。
〈治癒切除不能な進行・再発の胃癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は
「17.臨床成績」の項の内容を熟知し選択すること。
〈治癒切除不能な進行・再発の胃癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は
「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等
を参考にした上で、選択すること。
〈根治切除不能な進行・再発の食道癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は
「17.臨床成績」の項の内容を熟知した上で、選択すること。
〈根治切除不能な進行・再発の食道癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は
「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等
を参考にした上で、選択すること。
※1 本表は、令和5年 11 月 30 日の薬事・食品衛生審議会医薬品等安全対策部会に報告した内容について、「「医薬・生活衛生局からの定期報告」の報告対象等について」(令和3年7月 19 日 医薬品等行政評価・監視委員会決定)に基づき必要な追記等を行っ
たもの。
※2 「No.」は薬事・食品衛生審議会医薬品等安全対策部会の資料中で付与されている番号。
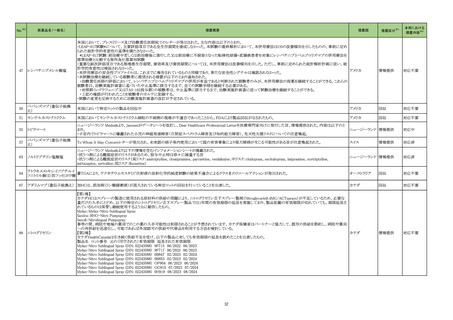
30
一般名
薬効
分類
改訂内容
改訂理由
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
23-38
ガラクトシル人血
清アルブミンジエ
チレントリアミン五
酢酸テクネチウム
(99mTc)
現行
430
放射性
医薬品
改訂案
(新設)
2. 禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
11. 副作用
(新設)
11. 副作用
11.1 重大な副作用
ショック、アナフィラキシー
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
アナフィラキシー関連症例を評
価した。症例の因果関係評価及
び使用上の注意の改訂要否に
ついて、専門委員の意見も聴取
した結果、本剤とショック及びア
ナフィラキシーとの因果関係の
否定できない症例が集積したこ
とから、使用上の注意を改訂す
ることが適切と判断した。
アナフィラキシー関連症例*の国内
症例の集積状況
医薬品の品質、有効性及び安全
性に関する情報の収集、調査、
検討等を踏まえ、医薬品の「使
用上の注意」の改訂が必要と考
えた。
-
4 例(うち、医薬品と事象との因果
関係が否定できない症例 4 例)
【死亡 0 例】
*:医薬品医療機器総合機構に
おける副作用等報告データベー
スに登録された症例
令和5年 11 月 24 日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
7. 用法及び用量に関連する注意
〈切除不能な進行・再発の非小細胞肺癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤
は、「17.臨床成績」の項の内容を熟知し、臨床試験において検討さ
れた患者の PD-L1 発現率を考慮した上で選択すること。
23-39
ニボルマブ(遺伝
子組換え)
429 そ
の他の
腫瘍用
薬
改訂案
7. 用法及び用量に関連する注意
〈切除不能な進行・再発の非小細胞肺癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤
は、「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライ
ン等を参考にした上で、臨床試験において検討された患者の PD-L1
発現率を考慮した上で選択すること。
〈非小細胞肺癌における術前補助療法〉
併用する他の抗悪性腫瘍剤は、「17.臨床成績」の項の内容を熟知し
選択すること。
〈非小細胞肺癌における術前補助療法〉
併用する他の抗悪性腫瘍剤は、「17.臨床成績」の項の内容を熟知
し、国内外の最新のガイドライン等を参考にした上で、選択すること。
〈治癒切除不能な進行・再発の胃癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は
「17.臨床成績」の項の内容を熟知し選択すること。
〈治癒切除不能な進行・再発の胃癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は
「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等
を参考にした上で、選択すること。
〈根治切除不能な進行・再発の食道癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は
「17.臨床成績」の項の内容を熟知した上で、選択すること。
〈根治切除不能な進行・再発の食道癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は
「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等
を参考にした上で、選択すること。
※1 本表は、令和5年 11 月 30 日の薬事・食品衛生審議会医薬品等安全対策部会に報告した内容について、「「医薬・生活衛生局からの定期報告」の報告対象等について」(令和3年7月 19 日 医薬品等行政評価・監視委員会決定)に基づき必要な追記等を行っ
たもの。
※2 「No.」は薬事・食品衛生審議会医薬品等安全対策部会の資料中で付与されている番号。
30