よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
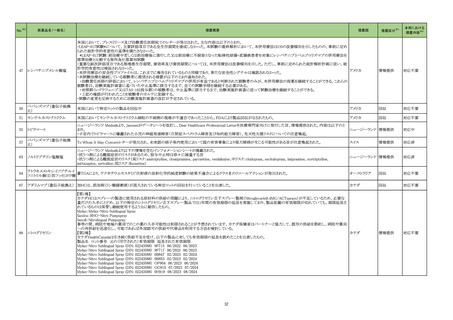
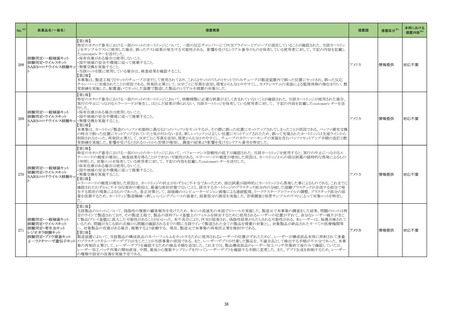
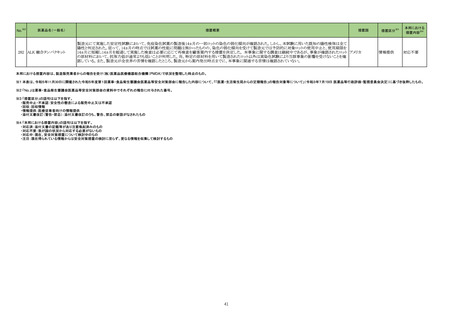
No.※2
医薬品名(一般名)
措置概要
措置国
措置区分※3
本邦における
措置内容※4
76
フランスにおいて非ステロイド性抗炎症薬(NSAIDs)の服用後に合併していた感染症が致死的な転帰となった症例が複数報告されたことを受け、仏ANSMよりNSAIDsの適
正使用について医療従事者及び患者に対して注意喚起がなされたもの。
・扁桃炎、鼻咽頭炎、耳炎、咳嗽、肺感染症、歯性感染症、皮膚病変又は水痘などの一般的な感染症において、疼痛や発熱がみられる場合はアセトアミノフェンを優先し
ケトプロフェン
て使用すること。
イブプロフェンピコノール
・疼痛や発熱がある場合は、NSAIDsの適正使用に関して以下に留意すること。
フランス
イブプロフェンピコノール含有 -NSAIDsは可能な限り低用量、短期間(発熱の場合は3日間、疼痛の場合は5日間)で処方、使用する。
一般用医薬品
-症状が消失したら投与を中止する。
-別のNSAIDsを同時に服用しない。
-水痘の場合はNSAIDsを使用しない。
・患児の保護者は、子供の体温が38.5℃を超えていないときは発熱に対する薬を飲ませる必要はない。
情報提供
注目
79
ゲムシタビン塩酸塩
特定バッチのゲムシタビン製品を回収中
イギリス
回収
対応不要
82
クロザピン
米国添付文書が改訂された。主な内容は以下のとおり。
・Boxed Warning、Warnings and Precautionsの項に、起立性低血圧、徐脈及び失神について、投与開始時のみならず再投与時にも注意が必要である、再開時には投与
量を減量する必要がある旨が追記された。
・Warnings and Precautions、Adverse Reactionsの項に、腸穿孔、潰瘍、壊死が追記された。
アメリカ
添付文書改
訂(警告・禁
忌)
注目
88
クエチアピンフマル酸塩
【第1報】【第2報】【第3報】
豪TGAは、許容限度値を超えるN-Nitroso-aryl piperazineが検出されたため、クエチアピンフマル酸塩錠25mg1バッチがリコールされたことを公表した。
オーストラリア
回収
注目
91
米国内で流通している当該製品の特定ロットにおいて、バッファー抽出液が細菌汚染されていることが確認された。バッファー抽出液に直接接触することで健康被害の可
SARS-CoV-2 ラピッド抗 能性があること、また、細菌汚染が検査の性能に影響を与える可能性があることから、該当ロットの自主回収を行う。 バッファー抽出液の細菌汚染は、バッファー抽出液の
アメリカ
原テスト
特定の原料ロットが原因であると特定され、問題の原料ロットは当該製品の特定ロットにのみ使用されており、他製品への影響はないことが確認された。今後の対策とし
て、原料ロットおよび製造工程における細菌汚染を防止するため、品質管理試験の強化を行う。
回収
対応不要
97
10%塩化カルシウム注射液の米国添付文書が改訂された。主な改訂内容は以下の通り。
・Contraindications にセフトリアキソンの静脈内投与が必要な(または必要と予想される)新生児(生後28日まで)(セフトリアキソン-カルシウムの沈殿の危険性があるため)
の追記
乳酸リンゲル液
・Warnings and Precautions及びAdverse Reactionsに以下の追記
乳酸リンゲル液(マルトース
-血管内セフトリアキソン-カルシウム沈殿物による末端臓器障害
加)
-急速投与による低血圧、徐脈、不整脈、失神
酢酸リンゲル液(ブドウ糖加) -ジゴキシン併用時の不整脈
塩化カルシウム水和物
-組織壊死・石灰沈着症
アメリカ
乳酸リンゲル液(ソルビトール -アルミニウム毒性
加)
・Pediatric Useに以下の内容の追記
リンゲル液
-新生児がセフトリアキソンの静脈内投与を必要とする (又は必要となると予想される) 場合には塩化カルシウム注射液は禁忌である旨
酢酸リンゲル液
-塩化カルシウム注射液とセフトリアキソンを混合しないこと。
乳酸リンゲル液(ブドウ糖加) -異なる輸液ラインや異なる輸液部位を使用する場合であっても、セフトリアキソンと同時に投与しない旨
-塩化カルシウム注射液には、中枢神経系や骨毒性に関与する可能性のあるアルミニウムが含まれており、腎機能が未熟であるため、塩化カルシウム注射による長期の非
経口栄養療法を受けている早産児では、アルミニウム毒性のリスクが高くなる可能性がある旨
・Renal Impairmentに、推奨用量範囲内の最低用量で開始し、血清カルシウム値を頻繁に監視する旨の追記
添付文書改
訂(警告・禁
忌)
注目
情報提供
対応不要
回収
対応不要
情報提供
対応済
エジプトPharmacovigilance Center (EPVC)は、医療従事者に対し、セファロスポリン系の薬剤(セフトリアキソンとセフォタキシムを含む)の投与前に実施すべき、重度の過
敏反応、アナフィラキシー、その他の生命を脅かす有害事象のリスクを最小化するための安全対策として Direct Healthcare Professional Communication(DHPC)を発行し
た。主な内容は下記の通り。
セフトリアキソンナトリウム水和
103
・昨今、セフォタキシム及びセフトリアキソンの不適切な投与、又は皮内反応テストを行わずに投与したことに関連する可能性のある過敏症、アナフィラキシー及び生命を エジプト
物
脅かす有害事象の報告を受けている。
・投与前に本剤及び他のセファロスポリン、又は他の種類のベータラクタム系薬剤に対する過敏症反応の病歴の有無を確認すること。
・皮内テストを行うこと。
105
トロピカミド・フェニレフリン塩
酸塩
108 フェブキソスタット
米国FDAは、無菌性保証欠如のためフェニレフリン塩酸塩注100μg/mLシリンジについて、クラスⅡの自主回収を実施していると公表した。
アメリカ
英MHRAのDrug Safety Updateにおいて、特に尿酸結晶やtophiの負荷が高いことが確認されている患者や尿酸降下療法を開始する患者で、心血管疾患の既往のある場
イギリス
合では、フェブキソスタットを処方する場合は注意が必要である旨が医療従事者に情報提供された。
33
医薬品名(一般名)
措置概要
措置国
措置区分※3
本邦における
措置内容※4
76
フランスにおいて非ステロイド性抗炎症薬(NSAIDs)の服用後に合併していた感染症が致死的な転帰となった症例が複数報告されたことを受け、仏ANSMよりNSAIDsの適
正使用について医療従事者及び患者に対して注意喚起がなされたもの。
・扁桃炎、鼻咽頭炎、耳炎、咳嗽、肺感染症、歯性感染症、皮膚病変又は水痘などの一般的な感染症において、疼痛や発熱がみられる場合はアセトアミノフェンを優先し
ケトプロフェン
て使用すること。
イブプロフェンピコノール
・疼痛や発熱がある場合は、NSAIDsの適正使用に関して以下に留意すること。
フランス
イブプロフェンピコノール含有 -NSAIDsは可能な限り低用量、短期間(発熱の場合は3日間、疼痛の場合は5日間)で処方、使用する。
一般用医薬品
-症状が消失したら投与を中止する。
-別のNSAIDsを同時に服用しない。
-水痘の場合はNSAIDsを使用しない。
・患児の保護者は、子供の体温が38.5℃を超えていないときは発熱に対する薬を飲ませる必要はない。
情報提供
注目
79
ゲムシタビン塩酸塩
特定バッチのゲムシタビン製品を回収中
イギリス
回収
対応不要
82
クロザピン
米国添付文書が改訂された。主な内容は以下のとおり。
・Boxed Warning、Warnings and Precautionsの項に、起立性低血圧、徐脈及び失神について、投与開始時のみならず再投与時にも注意が必要である、再開時には投与
量を減量する必要がある旨が追記された。
・Warnings and Precautions、Adverse Reactionsの項に、腸穿孔、潰瘍、壊死が追記された。
アメリカ
添付文書改
訂(警告・禁
忌)
注目
88
クエチアピンフマル酸塩
【第1報】【第2報】【第3報】
豪TGAは、許容限度値を超えるN-Nitroso-aryl piperazineが検出されたため、クエチアピンフマル酸塩錠25mg1バッチがリコールされたことを公表した。
オーストラリア
回収
注目
91
米国内で流通している当該製品の特定ロットにおいて、バッファー抽出液が細菌汚染されていることが確認された。バッファー抽出液に直接接触することで健康被害の可
SARS-CoV-2 ラピッド抗 能性があること、また、細菌汚染が検査の性能に影響を与える可能性があることから、該当ロットの自主回収を行う。 バッファー抽出液の細菌汚染は、バッファー抽出液の
アメリカ
原テスト
特定の原料ロットが原因であると特定され、問題の原料ロットは当該製品の特定ロットにのみ使用されており、他製品への影響はないことが確認された。今後の対策とし
て、原料ロットおよび製造工程における細菌汚染を防止するため、品質管理試験の強化を行う。
回収
対応不要
97
10%塩化カルシウム注射液の米国添付文書が改訂された。主な改訂内容は以下の通り。
・Contraindications にセフトリアキソンの静脈内投与が必要な(または必要と予想される)新生児(生後28日まで)(セフトリアキソン-カルシウムの沈殿の危険性があるため)
の追記
乳酸リンゲル液
・Warnings and Precautions及びAdverse Reactionsに以下の追記
乳酸リンゲル液(マルトース
-血管内セフトリアキソン-カルシウム沈殿物による末端臓器障害
加)
-急速投与による低血圧、徐脈、不整脈、失神
酢酸リンゲル液(ブドウ糖加) -ジゴキシン併用時の不整脈
塩化カルシウム水和物
-組織壊死・石灰沈着症
アメリカ
乳酸リンゲル液(ソルビトール -アルミニウム毒性
加)
・Pediatric Useに以下の内容の追記
リンゲル液
-新生児がセフトリアキソンの静脈内投与を必要とする (又は必要となると予想される) 場合には塩化カルシウム注射液は禁忌である旨
酢酸リンゲル液
-塩化カルシウム注射液とセフトリアキソンを混合しないこと。
乳酸リンゲル液(ブドウ糖加) -異なる輸液ラインや異なる輸液部位を使用する場合であっても、セフトリアキソンと同時に投与しない旨
-塩化カルシウム注射液には、中枢神経系や骨毒性に関与する可能性のあるアルミニウムが含まれており、腎機能が未熟であるため、塩化カルシウム注射による長期の非
経口栄養療法を受けている早産児では、アルミニウム毒性のリスクが高くなる可能性がある旨
・Renal Impairmentに、推奨用量範囲内の最低用量で開始し、血清カルシウム値を頻繁に監視する旨の追記
添付文書改
訂(警告・禁
忌)
注目
情報提供
対応不要
回収
対応不要
情報提供
対応済
エジプトPharmacovigilance Center (EPVC)は、医療従事者に対し、セファロスポリン系の薬剤(セフトリアキソンとセフォタキシムを含む)の投与前に実施すべき、重度の過
敏反応、アナフィラキシー、その他の生命を脅かす有害事象のリスクを最小化するための安全対策として Direct Healthcare Professional Communication(DHPC)を発行し
た。主な内容は下記の通り。
セフトリアキソンナトリウム水和
103
・昨今、セフォタキシム及びセフトリアキソンの不適切な投与、又は皮内反応テストを行わずに投与したことに関連する可能性のある過敏症、アナフィラキシー及び生命を エジプト
物
脅かす有害事象の報告を受けている。
・投与前に本剤及び他のセファロスポリン、又は他の種類のベータラクタム系薬剤に対する過敏症反応の病歴の有無を確認すること。
・皮内テストを行うこと。
105
トロピカミド・フェニレフリン塩
酸塩
108 フェブキソスタット
米国FDAは、無菌性保証欠如のためフェニレフリン塩酸塩注100μg/mLシリンジについて、クラスⅡの自主回収を実施していると公表した。
アメリカ
英MHRAのDrug Safety Updateにおいて、特に尿酸結晶やtophiの負荷が高いことが確認されている患者や尿酸降下療法を開始する患者で、心血管疾患の既往のある場
イギリス
合では、フェブキソスタットを処方する場合は注意が必要である旨が医療従事者に情報提供された。
33