よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
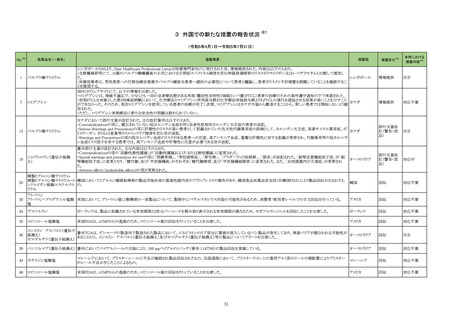
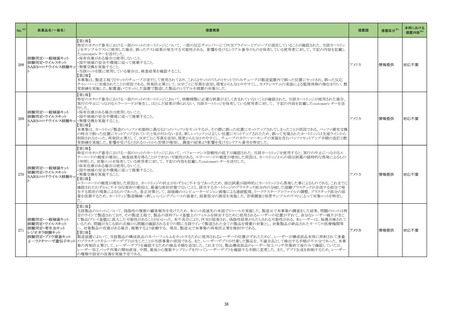
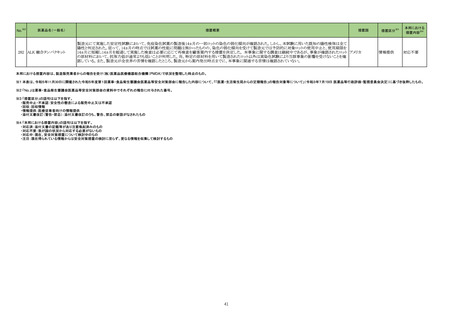
No.※2
医薬品名(一般名)
措置概要
措置国
措置区分※3
ニュージーランドMedsafeはレボチロキシンナトリウムのデータシートを改訂したことを公表した。改訂内容は以下のとおり。
レボチロキシンナトリウム水和 ・「Contraindications」の項に、急性心筋梗塞、急性膵炎が追記された。
146
物
・「Warnings and precautions」の項にビオチンによる甲状腺免疫測定法への干渉について追記された。
・「Interactions」の項に、St John’s wortとビオチンが追記された。
添付文書改
ニュージーランド 訂(警告・禁
忌)
デキサメタゾン製剤(注射剤)の豪州添付文書が改訂された。改訂内容は以下のとおり。
・「Contraindications」の項に、菌血症、関節不安定、注射部位感染が追記された。
デキサメタゾンプロピオン酸エ ・「Special warnings and precautions」の項に、全身性ステロイドの投与により褐色細胞腫クリーゼが報告されている旨が追記された。
153
ステル
・「Interactions with other medicines and other forms of interactions」の項に、フェノバルビタール、利尿薬、血糖降下薬、強心配糖体等が追記された。
・「Fertility, pregnancy and lactation」の項に、新生児低血糖のリスク増加について追記された。
・「Adverse effects (undesirable effects)」の項に、リンパ組織の減少、免疫反応の低下、ワクチン接種に対する反応性の低下、健忘症、錯乱が追記された。
オーストラリア
本邦における
措置内容※4
注目
添付文書改
訂(警告・禁
忌)
対応不要
162 エポプロステノールナトリウム
英国において、肺動脈性高血圧症(PAH)治療に使用されるフローラン(エポプロステノールナトリウム)調製後溶液の使用条件の変更に関する医療提供専門家向けレター
(DHCPL)が発行された。主な内容は以下のとおり。
・医療従事者に対してエポプロステノールナトリウム濃度150000 ng/mL、温度25℃及び30℃の場合の調製後溶液の投与終了までの時間に関する変更を通知する。
・使用時の安定性に関するIn use stability試験において、現在添付文書で規定している調製溶液の投与終了までの時間を経過するとエポプロステノールナトリウムの含量
が規格を下回ることが判明したため、今回の変更に至った。
イギリス
・本変更は、PAH治療に使用されるエポプロステノールナトリウム力価0.5及び1.5 mg製剤に対して適用される。エポプロステノールナトリウム調製溶液は新たに調製される
か、または2℃から8℃で8日間まで冷蔵保管するかの条件での使用が可能だが、いずれの条件においても、調製溶液の投与終了までの時間は現行から以下の通りに変
更する。
25℃以下:72時間から48時間へ変更。
30℃以下:48時間から36時間へ変更。
情報提供
対応中
164 プロゲステロン
2023年2月以降に製造されたプロゲステロン膣錠4ロットの最終QC試験中にBurkholderia種の存在が認められたことから、該当ロットは市場に流通していないものの、予防 デンマーク、
的措置として、同時期に製造されたロットのうち市場に出荷されたものについては回収することとし、カナダにてクラスII回収が行われた。
カナダ
回収
対応不要
情報提供
対応済
回収
対応不要
165
ブリナツモマブ(遺伝子組換
え)
20180257 試験に参加する治験責任医師にDear Investigator Letterが送付された。主な内容は以下のとおり。
・中枢神経系病変の既往歴を有する被験者が本試験に登録されないよう、治験実施計画書の既存の除外基準をさらに明確にすること。
アメリカ
20180257 試験:再発又は難治性のB前駆細胞性急性リンパ芽球性白血病成人患者を対象とした、ブリナツモマブ(遺伝子組換え)の皮下投与を検討する第1/2相非盲検
試験
2023年4月5日、豪州において市販後でのみ流通した組換えコロナウイルス(SARS-CoV-2)ワクチンの10ドーズバイアル(バッチ4302MF031、3,236,200回分)の相対力価
が規格外(out of specification、以下OOS)であることが重大な安全性問題(Significant Safety Issue、以下SSI)に該当する可能性があるとして、豪TGAに報告された。当該
組換えコロナウイルス(SARS
177
バッチは2023年4月28日にクラス2レベルで回収された。2023年5月5日、豪TGAはこのOOSをSSIとは見なさないことを確認した。当該ロットについて、製品に関する苦情、 オーストラリア
-CoV-2)ワクチン
力価に関連する有害事象及び薬効欠如は報告されていない。OOSの結果は、81~85%の規格に対して69~78%であることが確認された。他のバッチに影響はなく、回収
は完了した。
178 ヒドロキシカルバミド
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Boxed WarningのMyelosuppressionについて、骨髄機能が著しく抑制されている場合は本剤を投与しない旨が追記された。
アメリカ
添付文書改
訂(警告・禁
忌)
対応済
チェコ
回収
対応不要
182
フィブリノゲン加第13因子
フィブリノゲン配合剤
チェコにおいて、HAEMOCOMPLETTAN P(フィブリノゲン製剤)の1ロット(P100544787)について微生物混入の危険性があるため、自主回収された。
200
フルデオキシグルコース(18
F)
フルデオキシグルコース(18F)含有製剤の出荷後の品質管理試験におい て、製品仕様に適合しないバッチである(残存エタノール濃度の基準値からの超過)ことが判明
オーストラリア
し、豪州TGAによりClassIIのリコールアクションが発出された。
回収
対応不要
201
フルデオキシグルコース(18
F)
フルデオキシグルコース(18F)含有製剤の出荷後の品質管理試験におい て、製品仕様に適合しないバッチである(残存エタノール濃度の基準値からの超過)ことが判明
オーストラリア
し、豪州TGAによりClassIIのリコールアクションが発出された。
回収
対応不要
203 クロミフェンクエン酸塩
仏ANSMからクロミフェンクエン酸塩について、医療関係者に対してDirect healthcare professional communications(DHPC)が発出され、以下が注意喚起された。
・かすみ目、視力の低下、光視、及び閃輝暗点(斑点または閃光)等の視覚障害は、既知のリスクである。
・クロミフェンの使用により、視神経炎、虚血性視神経障害、網膜中心静脈閉塞、網膜剥離、硝子体剥離等の新たな視覚の有害事象が報告されており、クロミフェンの中
止後、特に投与量や治療期間を増加した場合、場合によっては視覚障害(失明)を引き起こす。
・治療の開始時に、患者にはそのリスクについて警告し、視覚障害が現れた場合は直ちに治療を中止し、医師に知らせるべきであると警告する必要がある。
・患者に視覚異常の症状が認められた場合は精密な眼科検査が必要であり、他の原因が認められなければクロミフェンの投与を恒久的に中止するべきである。
・過去又は現在の治療経過においてクロミフェンの使用による重要な視覚症状が確定診断されている患者については、クロミフェンの使用は禁忌とされた。
情報提供
注目
204 トラネキサム酸
米国FDAは機関誌のEnforcement Report 2023年6月21日号において、 トラネキサム酸製剤の一部の米国製販企業において、規格に適合しない製品が確認されたことか
アメリカ
ら、以下のロットにおいて、Class III の自主回収が行われたことが報告された。(ロット番号:X220317A、X220318A、使用期限 : 2025年9月)
回収
対応不要
35
フランス
医薬品名(一般名)
措置概要
措置国
措置区分※3
ニュージーランドMedsafeはレボチロキシンナトリウムのデータシートを改訂したことを公表した。改訂内容は以下のとおり。
レボチロキシンナトリウム水和 ・「Contraindications」の項に、急性心筋梗塞、急性膵炎が追記された。
146
物
・「Warnings and precautions」の項にビオチンによる甲状腺免疫測定法への干渉について追記された。
・「Interactions」の項に、St John’s wortとビオチンが追記された。
添付文書改
ニュージーランド 訂(警告・禁
忌)
デキサメタゾン製剤(注射剤)の豪州添付文書が改訂された。改訂内容は以下のとおり。
・「Contraindications」の項に、菌血症、関節不安定、注射部位感染が追記された。
デキサメタゾンプロピオン酸エ ・「Special warnings and precautions」の項に、全身性ステロイドの投与により褐色細胞腫クリーゼが報告されている旨が追記された。
153
ステル
・「Interactions with other medicines and other forms of interactions」の項に、フェノバルビタール、利尿薬、血糖降下薬、強心配糖体等が追記された。
・「Fertility, pregnancy and lactation」の項に、新生児低血糖のリスク増加について追記された。
・「Adverse effects (undesirable effects)」の項に、リンパ組織の減少、免疫反応の低下、ワクチン接種に対する反応性の低下、健忘症、錯乱が追記された。
オーストラリア
本邦における
措置内容※4
注目
添付文書改
訂(警告・禁
忌)
対応不要
162 エポプロステノールナトリウム
英国において、肺動脈性高血圧症(PAH)治療に使用されるフローラン(エポプロステノールナトリウム)調製後溶液の使用条件の変更に関する医療提供専門家向けレター
(DHCPL)が発行された。主な内容は以下のとおり。
・医療従事者に対してエポプロステノールナトリウム濃度150000 ng/mL、温度25℃及び30℃の場合の調製後溶液の投与終了までの時間に関する変更を通知する。
・使用時の安定性に関するIn use stability試験において、現在添付文書で規定している調製溶液の投与終了までの時間を経過するとエポプロステノールナトリウムの含量
が規格を下回ることが判明したため、今回の変更に至った。
イギリス
・本変更は、PAH治療に使用されるエポプロステノールナトリウム力価0.5及び1.5 mg製剤に対して適用される。エポプロステノールナトリウム調製溶液は新たに調製される
か、または2℃から8℃で8日間まで冷蔵保管するかの条件での使用が可能だが、いずれの条件においても、調製溶液の投与終了までの時間は現行から以下の通りに変
更する。
25℃以下:72時間から48時間へ変更。
30℃以下:48時間から36時間へ変更。
情報提供
対応中
164 プロゲステロン
2023年2月以降に製造されたプロゲステロン膣錠4ロットの最終QC試験中にBurkholderia種の存在が認められたことから、該当ロットは市場に流通していないものの、予防 デンマーク、
的措置として、同時期に製造されたロットのうち市場に出荷されたものについては回収することとし、カナダにてクラスII回収が行われた。
カナダ
回収
対応不要
情報提供
対応済
回収
対応不要
165
ブリナツモマブ(遺伝子組換
え)
20180257 試験に参加する治験責任医師にDear Investigator Letterが送付された。主な内容は以下のとおり。
・中枢神経系病変の既往歴を有する被験者が本試験に登録されないよう、治験実施計画書の既存の除外基準をさらに明確にすること。
アメリカ
20180257 試験:再発又は難治性のB前駆細胞性急性リンパ芽球性白血病成人患者を対象とした、ブリナツモマブ(遺伝子組換え)の皮下投与を検討する第1/2相非盲検
試験
2023年4月5日、豪州において市販後でのみ流通した組換えコロナウイルス(SARS-CoV-2)ワクチンの10ドーズバイアル(バッチ4302MF031、3,236,200回分)の相対力価
が規格外(out of specification、以下OOS)であることが重大な安全性問題(Significant Safety Issue、以下SSI)に該当する可能性があるとして、豪TGAに報告された。当該
組換えコロナウイルス(SARS
177
バッチは2023年4月28日にクラス2レベルで回収された。2023年5月5日、豪TGAはこのOOSをSSIとは見なさないことを確認した。当該ロットについて、製品に関する苦情、 オーストラリア
-CoV-2)ワクチン
力価に関連する有害事象及び薬効欠如は報告されていない。OOSの結果は、81~85%の規格に対して69~78%であることが確認された。他のバッチに影響はなく、回収
は完了した。
178 ヒドロキシカルバミド
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Boxed WarningのMyelosuppressionについて、骨髄機能が著しく抑制されている場合は本剤を投与しない旨が追記された。
アメリカ
添付文書改
訂(警告・禁
忌)
対応済
チェコ
回収
対応不要
182
フィブリノゲン加第13因子
フィブリノゲン配合剤
チェコにおいて、HAEMOCOMPLETTAN P(フィブリノゲン製剤)の1ロット(P100544787)について微生物混入の危険性があるため、自主回収された。
200
フルデオキシグルコース(18
F)
フルデオキシグルコース(18F)含有製剤の出荷後の品質管理試験におい て、製品仕様に適合しないバッチである(残存エタノール濃度の基準値からの超過)ことが判明
オーストラリア
し、豪州TGAによりClassIIのリコールアクションが発出された。
回収
対応不要
201
フルデオキシグルコース(18
F)
フルデオキシグルコース(18F)含有製剤の出荷後の品質管理試験におい て、製品仕様に適合しないバッチである(残存エタノール濃度の基準値からの超過)ことが判明
オーストラリア
し、豪州TGAによりClassIIのリコールアクションが発出された。
回収
対応不要
203 クロミフェンクエン酸塩
仏ANSMからクロミフェンクエン酸塩について、医療関係者に対してDirect healthcare professional communications(DHPC)が発出され、以下が注意喚起された。
・かすみ目、視力の低下、光視、及び閃輝暗点(斑点または閃光)等の視覚障害は、既知のリスクである。
・クロミフェンの使用により、視神経炎、虚血性視神経障害、網膜中心静脈閉塞、網膜剥離、硝子体剥離等の新たな視覚の有害事象が報告されており、クロミフェンの中
止後、特に投与量や治療期間を増加した場合、場合によっては視覚障害(失明)を引き起こす。
・治療の開始時に、患者にはそのリスクについて警告し、視覚障害が現れた場合は直ちに治療を中止し、医師に知らせるべきであると警告する必要がある。
・患者に視覚異常の症状が認められた場合は精密な眼科検査が必要であり、他の原因が認められなければクロミフェンの投与を恒久的に中止するべきである。
・過去又は現在の治療経過においてクロミフェンの使用による重要な視覚症状が確定診断されている患者については、クロミフェンの使用は禁忌とされた。
情報提供
注目
204 トラネキサム酸
米国FDAは機関誌のEnforcement Report 2023年6月21日号において、 トラネキサム酸製剤の一部の米国製販企業において、規格に適合しない製品が確認されたことか
アメリカ
ら、以下のロットにおいて、Class III の自主回収が行われたことが報告された。(ロット番号:X220317A、X220318A、使用期限 : 2025年9月)
回収
対応不要
35
フランス