よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1
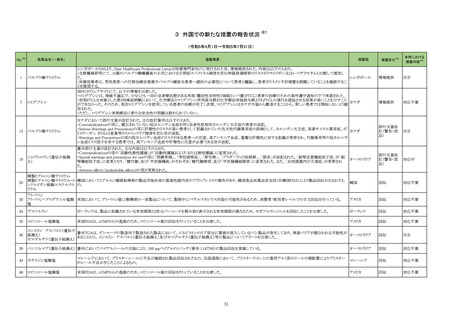
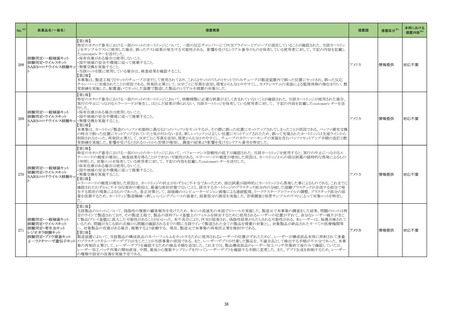
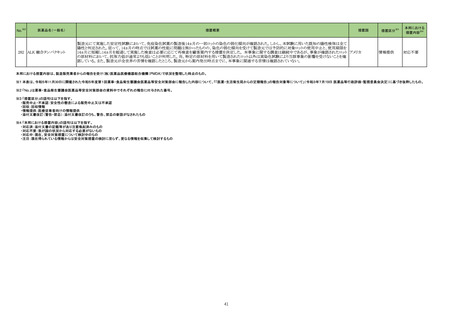
製造販売承認された医薬品の情報
(令和5年8月21日~令和5年11月30日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
2
3
カテゴリー
※2
承認日
③海外承認なし R5.9.25
③海外承認なし R5.9.25
③海外承認なし R5.9.25
販
売
名
(製造販売業者名)
アレモ皮下注15 mg
同 皮下注60 mg
同 皮下注150 mg
同 皮下注300 mg
(ノボ ノルディスク ファーマ㈱)
クイントバック水性懸濁注射用
(KMバイオロジクス㈱ )
フェスゴ配合皮下注MA
同 配合皮下注IN
(中外製薬㈱)
有効成分名
コンシズマブ(遺伝子
組換え)
百日せき菌の防御抗原
ジフテリアトキソイド
破傷風トキソイド
不活化ポリオウイルス
1~3型(Sabin株)
破傷風トキソイド結合
インフルエンザ菌b型
多糖
ペルツズマブ(遺伝子
組換え)、トラスツズ
マブ(遺伝子組換え)
及びボルヒアルロニ
ダーゼ アルファ(遺
伝子組換え)
効能・効果等
海外での使用実績
※審査報告書から抜粋
血液凝固第VIII因子又は第IX因子に対するイン
ヒビターを保有する先天性血友病患者におけ 2023 年 4 月現在カナダで承認されてお
る出血傾向の抑制
り、米国及び欧州において審査中である。
【希少疾病用医薬品】
承認条件
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
2. 日本人での投与経験が極めて限られていることから、製造販売後、一定数
の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調
査を実施することにより、本剤の使用患者の背景情報を把握するとともに、
本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用
に必要な措置を講じること。
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
血栓塞栓症
○重要な潜在的リスク
ショック、アナフィラキシー、免疫原性
○重要な不足情報
該当なし
○有効性に関する検討事項
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査
・製造販売後臨床試験
○有効性に関する調査・試験の計画の概要
該当無し
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け適正使用資材の作成と提供
・患者向け適正使用資材の作成と提供
百日せき、ジフテリア、破傷風、急性灰白髄
2022 年 12 月時点で、本剤はいずれの国又
炎及びインフルエンザ菌b型による感染症の
医薬品リスク管理計画を策定の上、適切に実施すること。
は地域においても承認されていない。
予防
○重要な特定されたリスク
ショック、アナフィラキシー、血小板減少性紫斑病、脳症、けいれん(熱性けいれ
んを含む)
○重要な潜在的リスク
該当なし
○重要な不足情報
該当なし
○有効性に関する検討事項
該当なし
○追加の医薬品安全性監視活動
・市販直後調査、一般使用成績調査
○有効性に関する調査・試験の計画の概要
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
米国及び EU では、FeDeriCa 試験を主要な
臨床試験成績とした本剤の承認申請が、それ
ぞれ 2019 年12 月及び2020 年 1 月に行
われ、それぞれ 2020 年 6 月及び2020 年
12 月に審査報告書の表 1 に示す効能・効果
HER2陽性の乳癌、がん化学療法後に増悪し にて承認された。
たHER2陽性の治癒切除不能な進行・再発の なお、2023 年 3 月時点において、本剤は 医薬品リスク管理計画を策定の上、適切に実施すること。
結腸・直腸癌
HER2 陽性の乳癌に係る効能・効果にて、
100 の国又は地域で承認されており、がん
化学療法後に増悪した HER2 陽性の治癒切
除不能な進行・再発の結腸・直腸癌に係る効
能・効果にて、本剤が承認されている国又は
地域はない。
○重要な特定されたリスク
心機能障害(左室機能不全・心不全)、過敏症・アナフィラキシー、骨髄抑制、間
質性肺疾患、Infusion reaction、腫瘍崩壊症候群、肝不全・肝障害、腎障害、昏
睡・脳血管障害・脳浮腫、感染症
○重要な潜在的リスク
なし
○重要な不足情報
なし
○有効性に関する検討事項
なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査(がん化学療法後に増悪した HER2 陽性の治癒切除不能な進
行・再発の結腸・直腸癌)
○有効性に関する調査・試験の計画の概要
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
2
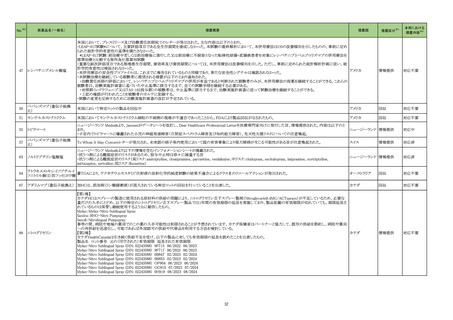
製造販売承認された医薬品の情報
(令和5年8月21日~令和5年11月30日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
2
3
カテゴリー
※2
承認日
③海外承認なし R5.9.25
③海外承認なし R5.9.25
③海外承認なし R5.9.25
販
売
名
(製造販売業者名)
アレモ皮下注15 mg
同 皮下注60 mg
同 皮下注150 mg
同 皮下注300 mg
(ノボ ノルディスク ファーマ㈱)
クイントバック水性懸濁注射用
(KMバイオロジクス㈱ )
フェスゴ配合皮下注MA
同 配合皮下注IN
(中外製薬㈱)
有効成分名
コンシズマブ(遺伝子
組換え)
百日せき菌の防御抗原
ジフテリアトキソイド
破傷風トキソイド
不活化ポリオウイルス
1~3型(Sabin株)
破傷風トキソイド結合
インフルエンザ菌b型
多糖
ペルツズマブ(遺伝子
組換え)、トラスツズ
マブ(遺伝子組換え)
及びボルヒアルロニ
ダーゼ アルファ(遺
伝子組換え)
効能・効果等
海外での使用実績
※審査報告書から抜粋
血液凝固第VIII因子又は第IX因子に対するイン
ヒビターを保有する先天性血友病患者におけ 2023 年 4 月現在カナダで承認されてお
る出血傾向の抑制
り、米国及び欧州において審査中である。
【希少疾病用医薬品】
承認条件
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
2. 日本人での投与経験が極めて限られていることから、製造販売後、一定数
の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調
査を実施することにより、本剤の使用患者の背景情報を把握するとともに、
本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用
に必要な措置を講じること。
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
血栓塞栓症
○重要な潜在的リスク
ショック、アナフィラキシー、免疫原性
○重要な不足情報
該当なし
○有効性に関する検討事項
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査
・製造販売後臨床試験
○有効性に関する調査・試験の計画の概要
該当無し
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け適正使用資材の作成と提供
・患者向け適正使用資材の作成と提供
百日せき、ジフテリア、破傷風、急性灰白髄
2022 年 12 月時点で、本剤はいずれの国又
炎及びインフルエンザ菌b型による感染症の
医薬品リスク管理計画を策定の上、適切に実施すること。
は地域においても承認されていない。
予防
○重要な特定されたリスク
ショック、アナフィラキシー、血小板減少性紫斑病、脳症、けいれん(熱性けいれ
んを含む)
○重要な潜在的リスク
該当なし
○重要な不足情報
該当なし
○有効性に関する検討事項
該当なし
○追加の医薬品安全性監視活動
・市販直後調査、一般使用成績調査
○有効性に関する調査・試験の計画の概要
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
米国及び EU では、FeDeriCa 試験を主要な
臨床試験成績とした本剤の承認申請が、それ
ぞれ 2019 年12 月及び2020 年 1 月に行
われ、それぞれ 2020 年 6 月及び2020 年
12 月に審査報告書の表 1 に示す効能・効果
HER2陽性の乳癌、がん化学療法後に増悪し にて承認された。
たHER2陽性の治癒切除不能な進行・再発の なお、2023 年 3 月時点において、本剤は 医薬品リスク管理計画を策定の上、適切に実施すること。
結腸・直腸癌
HER2 陽性の乳癌に係る効能・効果にて、
100 の国又は地域で承認されており、がん
化学療法後に増悪した HER2 陽性の治癒切
除不能な進行・再発の結腸・直腸癌に係る効
能・効果にて、本剤が承認されている国又は
地域はない。
○重要な特定されたリスク
心機能障害(左室機能不全・心不全)、過敏症・アナフィラキシー、骨髄抑制、間
質性肺疾患、Infusion reaction、腫瘍崩壊症候群、肝不全・肝障害、腎障害、昏
睡・脳血管障害・脳浮腫、感染症
○重要な潜在的リスク
なし
○重要な不足情報
なし
○有効性に関する検討事項
なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査(がん化学療法後に増悪した HER2 陽性の治癒切除不能な進
行・再発の結腸・直腸癌)
○有効性に関する調査・試験の計画の概要
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
2