よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
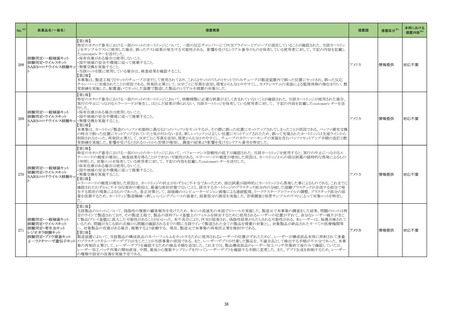
2 国内における市販後の安全対策の措置状況
[医薬品の使用上の注意の改訂について※1]
(令和5年6月 29 日~令和5年 11 月 29 日改訂指示分)
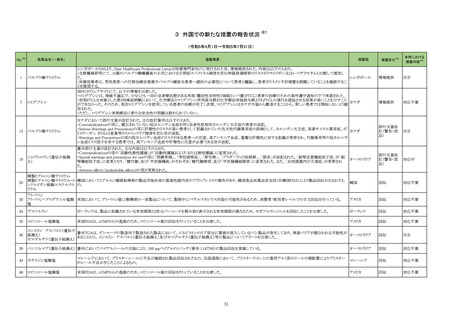
No.※2
一般名
薬効
分類
改訂内容
改訂理由
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
令和5年7月 20 日発出
【 「 医 療 用 医 薬 品 添 付 文 書 の記 載 要 領 について」 ( 平 成 9 年 4 月 25 日 付 け薬 発 第 606 号 局 長 通 知 ) に基 づく改 訂 ( 旧 記 載 要 領 ) 】
現行
23-12
アトルバスタチン
カルシウム水和物
エゼチミブ・アトル
バスタチンカルシ
ウム水和物
エゼチミブ・ロスバ
スタチンカルシウ
ム
シンバスタチン
ピタバスタチンカ
ルシウム水和物
ピタバスタチンカ
ルシウム水和物・
エゼチミブ
プラバスタチンナ
トリウム
フルバスタチンナ
トリウム
ロスバスタチンカ
ルシウム
アムロジピンベシ
ル酸塩・アトルバ
スタチンカルシウ
ム水和物
218
高脂血
症用剤
219
その他
の循環
器官用
薬
改訂案
慎重投与
(新設)
慎重投与
重症筋無力症又はその既往歴のある患者〔重症筋無力症(眼筋
型、全身型)が悪化又は再発することがある。〕
副作用
重大な副作用
(新設)
副作用
重大な副作用
重症筋無力症:
重症筋無力症(眼筋型、全身型)が発症又は悪化することがある
ので、観察を十分に行い、異常が認められた場合には投与を中
止し、適切な処置を行うこと。
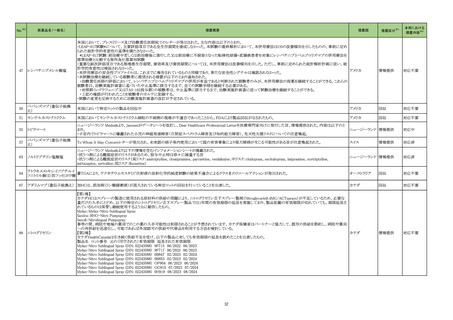
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領 )】
現行
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
重症筋無力症又はその既往歴のある患者
重症筋無力症(眼筋型、全身型)が悪化又は再発することが
ある。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
重症筋無力症
重症筋無力症(眼筋型、全身型)が発症又は悪化することが
ある。
5
重症筋無力症についての国内外
の症例、公表文献、及び国内外
のガイドラインを評価した。専門
委員の意見も聴取した結果、以
下の内容を踏まえ、使用上の注
意を改訂することが適切と判断
した。
・ 国内副作用症例において
HMG-CoA 還元酵素阻害薬
(以下、「スタチン」)と重症筋
無力症との因果関係が否定で
きない症例注 1 が認められてい
ること。
・ 公表文献において、スタチン
の再投与で重症筋無力症の
症状が再発した症例、スタチ
ンの中止で重症筋無力症の症
状が消失した症例等、スタチ
ンと重症筋無力症との因果関
係が否定できない症例が報告
注2
されていること。
・ 公表文献において、WHO 個
別症例安全性報告グローバル
データベース(VigiBase)注 3 に
おいて不均衡分析を行い、ス
タチンの重症筋無力症に関す
る副作用報告数がデータベー
ス全体から予測される値より
統計学的に有意に高かった
(報告オッズ比[95%信頼区
間] = 2.66[2.28-3.10])との報
告注 4,注 5 があること。また、機構
で実施した VigiBase の 2023
年 5 月 23 日時点のデータセ
ットを用いた不均衡分析にお
いても、同様の結果(重症筋
無力症:IC025 注 6 = 0.9、眼筋無
「重症筋無力症」、「眼筋無力症」
症例注 8 の 国内症例の集積状況
は以下のとおり。
①アトルバスタチンカルシウム水
和物
②シンバスタチン
③ピタバスタチンカルシウム水和
物
④プラバスタチンナトリウム
⑤フルバスタチンナトリウム
⑥ロスバスタチンカルシウム
⑦アムロジピンベシル酸塩・アトル
バスタチンカルシウム水和物
⑧エゼチミブ・アトルバスタチンカ
ルシウム水和物
⑨エゼチミブ・ロスバスタチンカル
シウム
⑩ピタバスタチンカルシウム水和
物・エゼチミブ
<重症筋無力症>
①4 例(うち、医薬品と事象との因
果関係が否定できない症例 1
例)
【死亡 0 例】
⑥1 例(うち、医薬品と事象との因
果関係が否定できない症例 0
例)
【死亡 0 例】
②~⑤、⑦~⑩ 0 例
<眼筋無力症>
①~⑩ 0 例
[医薬品の使用上の注意の改訂について※1]
(令和5年6月 29 日~令和5年 11 月 29 日改訂指示分)
No.※2
一般名
薬効
分類
改訂内容
改訂理由
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
令和5年7月 20 日発出
【 「 医 療 用 医 薬 品 添 付 文 書 の記 載 要 領 について」 ( 平 成 9 年 4 月 25 日 付 け薬 発 第 606 号 局 長 通 知 ) に基 づく改 訂 ( 旧 記 載 要 領 ) 】
現行
23-12
アトルバスタチン
カルシウム水和物
エゼチミブ・アトル
バスタチンカルシ
ウム水和物
エゼチミブ・ロスバ
スタチンカルシウ
ム
シンバスタチン
ピタバスタチンカ
ルシウム水和物
ピタバスタチンカ
ルシウム水和物・
エゼチミブ
プラバスタチンナ
トリウム
フルバスタチンナ
トリウム
ロスバスタチンカ
ルシウム
アムロジピンベシ
ル酸塩・アトルバ
スタチンカルシウ
ム水和物
218
高脂血
症用剤
219
その他
の循環
器官用
薬
改訂案
慎重投与
(新設)
慎重投与
重症筋無力症又はその既往歴のある患者〔重症筋無力症(眼筋
型、全身型)が悪化又は再発することがある。〕
副作用
重大な副作用
(新設)
副作用
重大な副作用
重症筋無力症:
重症筋無力症(眼筋型、全身型)が発症又は悪化することがある
ので、観察を十分に行い、異常が認められた場合には投与を中
止し、適切な処置を行うこと。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領 )】
現行
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
重症筋無力症又はその既往歴のある患者
重症筋無力症(眼筋型、全身型)が悪化又は再発することが
ある。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
重症筋無力症
重症筋無力症(眼筋型、全身型)が発症又は悪化することが
ある。
5
重症筋無力症についての国内外
の症例、公表文献、及び国内外
のガイドラインを評価した。専門
委員の意見も聴取した結果、以
下の内容を踏まえ、使用上の注
意を改訂することが適切と判断
した。
・ 国内副作用症例において
HMG-CoA 還元酵素阻害薬
(以下、「スタチン」)と重症筋
無力症との因果関係が否定で
きない症例注 1 が認められてい
ること。
・ 公表文献において、スタチン
の再投与で重症筋無力症の
症状が再発した症例、スタチ
ンの中止で重症筋無力症の症
状が消失した症例等、スタチ
ンと重症筋無力症との因果関
係が否定できない症例が報告
注2
されていること。
・ 公表文献において、WHO 個
別症例安全性報告グローバル
データベース(VigiBase)注 3 に
おいて不均衡分析を行い、ス
タチンの重症筋無力症に関す
る副作用報告数がデータベー
ス全体から予測される値より
統計学的に有意に高かった
(報告オッズ比[95%信頼区
間] = 2.66[2.28-3.10])との報
告注 4,注 5 があること。また、機構
で実施した VigiBase の 2023
年 5 月 23 日時点のデータセ
ットを用いた不均衡分析にお
いても、同様の結果(重症筋
無力症:IC025 注 6 = 0.9、眼筋無
「重症筋無力症」、「眼筋無力症」
症例注 8 の 国内症例の集積状況
は以下のとおり。
①アトルバスタチンカルシウム水
和物
②シンバスタチン
③ピタバスタチンカルシウム水和
物
④プラバスタチンナトリウム
⑤フルバスタチンナトリウム
⑥ロスバスタチンカルシウム
⑦アムロジピンベシル酸塩・アトル
バスタチンカルシウム水和物
⑧エゼチミブ・アトルバスタチンカ
ルシウム水和物
⑨エゼチミブ・ロスバスタチンカル
シウム
⑩ピタバスタチンカルシウム水和
物・エゼチミブ
<重症筋無力症>
①4 例(うち、医薬品と事象との因
果関係が否定できない症例 1
例)
【死亡 0 例】
⑥1 例(うち、医薬品と事象との因
果関係が否定できない症例 0
例)
【死亡 0 例】
②~⑤、⑦~⑩ 0 例
<眼筋無力症>
①~⑩ 0 例