よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
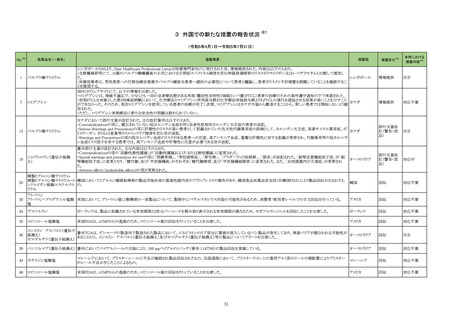
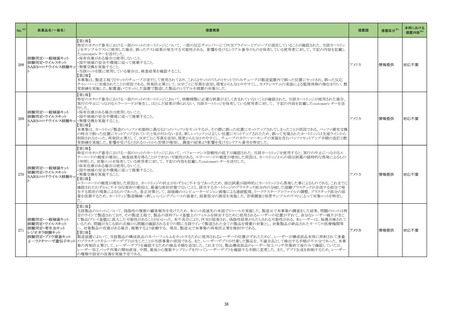
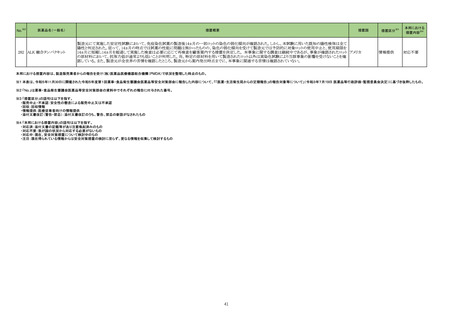
No.※2
医薬品名(一般名)
レボフロキサシン水和物
モキシフロキサシン塩酸塩
レボフロキサシン水和物
シタフロキサシン水和物
トスフロキサシントシル酸塩水
111 和物
ベタメタゾン・d-クロルフェニ
ラミンマレイン酸塩
オフロキサシン
ノルフロキサシン
ナジフロキサシン
措置概要
措置国
措置区分※3
本邦における
措置内容※4
【第1報】
欧州PRACがフルオロキノロン(FQ)系抗菌剤について、2018年10月のPRAC勧告に基づき、2019年にFQ系及びquinolone系抗菌薬に使用制限が導入されたが、EMAが
資金提供した研究によると、FQ系抗菌薬の使用は減少しているものの、これらの薬剤が推奨用途以外で処方されている可能性があり、使用制限の影響は軽度であったこ
とを踏まえ、再度の注意喚起を実施した。
6月8日までにDirect Healthcare Professional Communication (DHPC)がEU内の医療専門家に送信される予定である。DHPCは、FQ系及びquinolone系抗菌薬の使用を代
替治療選択肢のない患者に対する最後の治療に限定し、個々の患者にとってのベネフィットとリスクを慎重に評価した上でのみ使用する必要性を強調する内容である。
<2018年10月のPRAC勧告の内容>
PRACはFQ系及びquinolone系抗菌薬(経口,注射,吸入用)使用に関連した「機能障害を引き起こし、永続する可能性のある副作用(主に筋、腱、骨、神経)」のリスクに
対するレビューを踏まえ、以下に関する使用制限を勧告した。
・治療せずに回復する可能性のある感染症又は重篤ではない感染症の患者への使用
・旅行者の下痢又は下部尿路感染の再発予防への使用
・これまでにFQ系又はquinolone系抗菌薬で重篤な副作用が生じたことがある患者への使用
・軽度又は中等度の感染症の治療(これらの感染症について一般的に推奨された他の抗菌薬が使用できない場合を除く)への使用
また、特に高齢者、腎に障害のある患者、臓器移植を受けている患者や全身性corticosteroids治療を受けている患者においては、FQ系抗菌薬を注意して使用すべきで
ある。これらの患者集団では,FQ系及びquinolone系抗菌薬による腱損傷のリスクがより大きい。
【第2報】
ドイツ規制当局(BfArM)、フランス規制当局(ANSM)のホームページに同一内容を含む情報が掲載されており、同様の措置が講じられる予定である。
欧州連合、
ドイツ、
フランス
情報提供
対応不要
112 モンテルカストナトリウム
加HCは、モンテルカストナトリウム錠の不純物が規格外であったロット(646780)が確認されたことから、該当ロットを回収した。
カナダ
回収
対応不要
113 ピペラシリンナトリウム
米国において無菌保証の欠如のため、クラスⅡのリコールが発出され、該当製品(対象11製品)が回収された。
アメリカ
回収
対応不要
114 メトホルミン塩酸塩
仏ANSMは、医療専門家と患者に対し、特に腎機能障害、心呼吸器疾患、敗血症(重篤な感染)の患者におけるメトホルミンによる乳酸アシドーシスのリスクに関する警告
フランス
を公表した。
情報提供
対応済
117 ドンペリドン
フィリピン規制当局(FDA Philippines)は、ドンペリドンのステークホルダー会議において、ドンペリドンの添付文書 のContraindications 及びSpecial warnings and
precautions に心血管作用のリスク増大に関する情報を反映するよう指示した。また、 本リスクに伴い、ドンペリドンの分類がOTCから処方薬へ変更となった。
添付文書改
訂(警告・禁
忌)
注目
122 バルプロ酸ナトリウム
ニュージーランド Medsafeより、Dear Healthcare Professional Letterが医療専門家向けに発行された旨、情報提供された。内容は以下のとおり。
・北欧観察研究にて、受胎時にバルプロ酸による治療をうけた男性を親とする小児における自閉症スペクトラム障害を含む神経発達障害のリスクがラモトリギン又はレベチ
ラセタムと比較して増加した。バルプロ酸治療を受けた父親の児におけるリスクは5.6%~6.3%のであるのに対し、ラモトリギン又はレベチラセタム治療を受けた父親の児に
ニュージーランド 情報提供
おいては2.5%~3.6%であった。補足として、バルプロ酸治療を受けた母親の児における神経発達障害のリスクは約30%~40%である。
・医療従事者は、男性患者への代替治療法提案やバルプロ酸投与患者へ避妊の必要性について患者と議論し、患者がリスクと予防措置を認識していることを確認するこ
とを推奨する。
注目
128 プラバスタチンナトリウム
豪TGAにおいて、プラバスタチンの添付文書が改訂された。
・Dose and method of administrationの項に、他のHMG-CoA還元酵素阻害剤と同じく、フィブラートとの併用は推奨されず、避けるべきである旨を追記する。
・Contraindicationsの項にフィブラートとの併用、正常上限値の3倍を超える血清トランスアミナーゼ上昇を追記する。
・Special Warnings and precautions for useの項に、高用量を必要とする重度の高コレステロール血症において、特に重度の腎機能障害の患者と高齢者では注意が必要
であること、横紋筋融解症とミオパチー、フィブラートとの併用、CK値、糖尿病リスクに関する内容を追加する。
・ Interactions with other medicines and other forms of interactions、 Adverse effects (undesirable effects)の項を改訂する。
添付文書改
訂(警告・禁
忌)
注目
131 ニルマトレルビル・リトナビル
米国FDA承認による米国添付文書作成に伴い、米国ファクトシートが改訂された。主な内容は以下の通り。
・Boxed Warningが追加され、強力なCYP3A阻害剤であるリトナビルが含まれており、特定の併用薬の曝露量が増加し、重篤な、生命を脅かす、あるいは致命的な事象を
引き起こす可能性があること、本剤を処方する前に、患者が服用するすべての薬剤を確認し、併用薬の用量調節、休薬あるいはモニタリングの必要性を判断すること、本
アメリカ
剤による入院や死亡の減少というベネフィットを考慮し、個々の患者に対する相互作用のリスクを管理できるかについて検討すること、が記載された。
・Drug interactionsの項にベラパミルを追記。
・Advers Reactionsの項に、高血圧、Stevens-Johnson syndrome(SJS)、Toxic epidermal necrolysis (TEN)が追記。
添付文書改
訂(警告・禁
忌)
対応済
イギリス
オーストラリア
134
トロピカミド・フェニレフリン塩
酸塩
米国FDAは、無菌性保証欠如のためフェニレフリン/塩化ナトリウム含有250mLバッグ製剤について、クラスⅡの自主回収を実施していると公表した。
アメリカ
回収
対応不要
135
トロピカミド・フェニレフリン塩
酸塩
米国FDAは、製品カートン内に誤った製品が見つかったためフェニレフリン塩酸塩/デキストロメトルファン/グアイフェネシン小児用製剤について、クラスⅠの自主回収を
実施していると公表した。
アメリカ
回収
対応不要
炭酸ランタン含有製品の豪州添付文書における禁忌の項に腸閉塞、イレウス、宿便が追記された。
オーストラリア
添付文書改
訂(警告・禁
忌)
注目
142 炭酸ランタン水和物
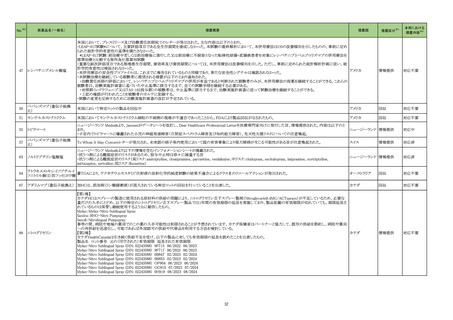
34
医薬品名(一般名)
レボフロキサシン水和物
モキシフロキサシン塩酸塩
レボフロキサシン水和物
シタフロキサシン水和物
トスフロキサシントシル酸塩水
111 和物
ベタメタゾン・d-クロルフェニ
ラミンマレイン酸塩
オフロキサシン
ノルフロキサシン
ナジフロキサシン
措置概要
措置国
措置区分※3
本邦における
措置内容※4
【第1報】
欧州PRACがフルオロキノロン(FQ)系抗菌剤について、2018年10月のPRAC勧告に基づき、2019年にFQ系及びquinolone系抗菌薬に使用制限が導入されたが、EMAが
資金提供した研究によると、FQ系抗菌薬の使用は減少しているものの、これらの薬剤が推奨用途以外で処方されている可能性があり、使用制限の影響は軽度であったこ
とを踏まえ、再度の注意喚起を実施した。
6月8日までにDirect Healthcare Professional Communication (DHPC)がEU内の医療専門家に送信される予定である。DHPCは、FQ系及びquinolone系抗菌薬の使用を代
替治療選択肢のない患者に対する最後の治療に限定し、個々の患者にとってのベネフィットとリスクを慎重に評価した上でのみ使用する必要性を強調する内容である。
<2018年10月のPRAC勧告の内容>
PRACはFQ系及びquinolone系抗菌薬(経口,注射,吸入用)使用に関連した「機能障害を引き起こし、永続する可能性のある副作用(主に筋、腱、骨、神経)」のリスクに
対するレビューを踏まえ、以下に関する使用制限を勧告した。
・治療せずに回復する可能性のある感染症又は重篤ではない感染症の患者への使用
・旅行者の下痢又は下部尿路感染の再発予防への使用
・これまでにFQ系又はquinolone系抗菌薬で重篤な副作用が生じたことがある患者への使用
・軽度又は中等度の感染症の治療(これらの感染症について一般的に推奨された他の抗菌薬が使用できない場合を除く)への使用
また、特に高齢者、腎に障害のある患者、臓器移植を受けている患者や全身性corticosteroids治療を受けている患者においては、FQ系抗菌薬を注意して使用すべきで
ある。これらの患者集団では,FQ系及びquinolone系抗菌薬による腱損傷のリスクがより大きい。
【第2報】
ドイツ規制当局(BfArM)、フランス規制当局(ANSM)のホームページに同一内容を含む情報が掲載されており、同様の措置が講じられる予定である。
欧州連合、
ドイツ、
フランス
情報提供
対応不要
112 モンテルカストナトリウム
加HCは、モンテルカストナトリウム錠の不純物が規格外であったロット(646780)が確認されたことから、該当ロットを回収した。
カナダ
回収
対応不要
113 ピペラシリンナトリウム
米国において無菌保証の欠如のため、クラスⅡのリコールが発出され、該当製品(対象11製品)が回収された。
アメリカ
回収
対応不要
114 メトホルミン塩酸塩
仏ANSMは、医療専門家と患者に対し、特に腎機能障害、心呼吸器疾患、敗血症(重篤な感染)の患者におけるメトホルミンによる乳酸アシドーシスのリスクに関する警告
フランス
を公表した。
情報提供
対応済
117 ドンペリドン
フィリピン規制当局(FDA Philippines)は、ドンペリドンのステークホルダー会議において、ドンペリドンの添付文書 のContraindications 及びSpecial warnings and
precautions に心血管作用のリスク増大に関する情報を反映するよう指示した。また、 本リスクに伴い、ドンペリドンの分類がOTCから処方薬へ変更となった。
添付文書改
訂(警告・禁
忌)
注目
122 バルプロ酸ナトリウム
ニュージーランド Medsafeより、Dear Healthcare Professional Letterが医療専門家向けに発行された旨、情報提供された。内容は以下のとおり。
・北欧観察研究にて、受胎時にバルプロ酸による治療をうけた男性を親とする小児における自閉症スペクトラム障害を含む神経発達障害のリスクがラモトリギン又はレベチ
ラセタムと比較して増加した。バルプロ酸治療を受けた父親の児におけるリスクは5.6%~6.3%のであるのに対し、ラモトリギン又はレベチラセタム治療を受けた父親の児に
ニュージーランド 情報提供
おいては2.5%~3.6%であった。補足として、バルプロ酸治療を受けた母親の児における神経発達障害のリスクは約30%~40%である。
・医療従事者は、男性患者への代替治療法提案やバルプロ酸投与患者へ避妊の必要性について患者と議論し、患者がリスクと予防措置を認識していることを確認するこ
とを推奨する。
注目
128 プラバスタチンナトリウム
豪TGAにおいて、プラバスタチンの添付文書が改訂された。
・Dose and method of administrationの項に、他のHMG-CoA還元酵素阻害剤と同じく、フィブラートとの併用は推奨されず、避けるべきである旨を追記する。
・Contraindicationsの項にフィブラートとの併用、正常上限値の3倍を超える血清トランスアミナーゼ上昇を追記する。
・Special Warnings and precautions for useの項に、高用量を必要とする重度の高コレステロール血症において、特に重度の腎機能障害の患者と高齢者では注意が必要
であること、横紋筋融解症とミオパチー、フィブラートとの併用、CK値、糖尿病リスクに関する内容を追加する。
・ Interactions with other medicines and other forms of interactions、 Adverse effects (undesirable effects)の項を改訂する。
添付文書改
訂(警告・禁
忌)
注目
131 ニルマトレルビル・リトナビル
米国FDA承認による米国添付文書作成に伴い、米国ファクトシートが改訂された。主な内容は以下の通り。
・Boxed Warningが追加され、強力なCYP3A阻害剤であるリトナビルが含まれており、特定の併用薬の曝露量が増加し、重篤な、生命を脅かす、あるいは致命的な事象を
引き起こす可能性があること、本剤を処方する前に、患者が服用するすべての薬剤を確認し、併用薬の用量調節、休薬あるいはモニタリングの必要性を判断すること、本
アメリカ
剤による入院や死亡の減少というベネフィットを考慮し、個々の患者に対する相互作用のリスクを管理できるかについて検討すること、が記載された。
・Drug interactionsの項にベラパミルを追記。
・Advers Reactionsの項に、高血圧、Stevens-Johnson syndrome(SJS)、Toxic epidermal necrolysis (TEN)が追記。
添付文書改
訂(警告・禁
忌)
対応済
イギリス
オーストラリア
134
トロピカミド・フェニレフリン塩
酸塩
米国FDAは、無菌性保証欠如のためフェニレフリン/塩化ナトリウム含有250mLバッグ製剤について、クラスⅡの自主回収を実施していると公表した。
アメリカ
回収
対応不要
135
トロピカミド・フェニレフリン塩
酸塩
米国FDAは、製品カートン内に誤った製品が見つかったためフェニレフリン塩酸塩/デキストロメトルファン/グアイフェネシン小児用製剤について、クラスⅠの自主回収を
実施していると公表した。
アメリカ
回収
対応不要
炭酸ランタン含有製品の豪州添付文書における禁忌の項に腸閉塞、イレウス、宿便が追記された。
オーストラリア
添付文書改
訂(警告・禁
忌)
注目
142 炭酸ランタン水和物
34