よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
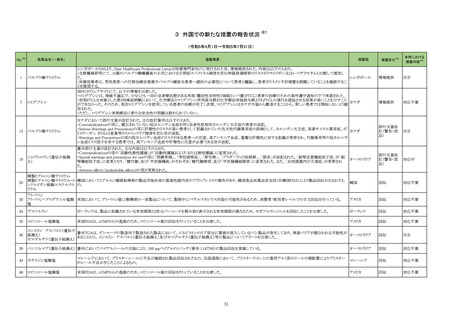
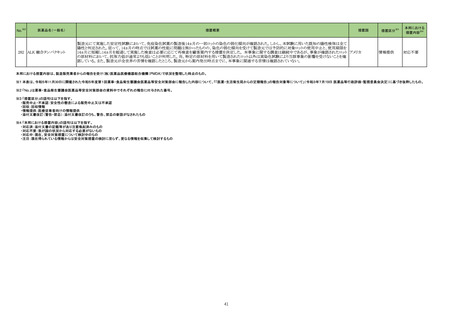
No.※2
一般名
薬効
分類
改訂内容
改訂理由
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
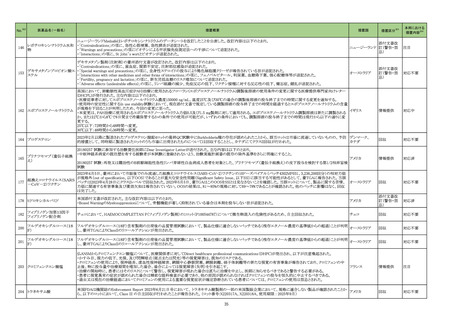
2314
ミノサイクリン塩酸
塩(経口剤、注射
剤)
615
主として
グラム
陽性・陰
性菌、リ
ケッチ
ア、クラ
ミジアに
作用す
るもの
現行
改訂案
副作用
重大な副作用
全身性紅斑性狼瘡(SLE)様症状の増悪:
全身性紅斑性狼瘡(SLE)様症状の増悪があらわれることがあるの
で、このような症状があらわれた場合には投与を中止し、適切な
処置を行うこと。
副作用
重大な副作用
ループス様症候群:
ループス様症候群があらわれることがあるので、このような症状
があらわれた場合には投与を中止し、適切な処置を行うこと。特
に 6 ヵ月以上使用している長期投与例で多く報告されている。
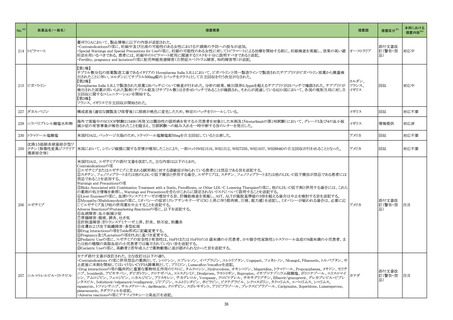
現行
625 抗
ウイル
ス剤
ループス様症候群関連症例*の国
内症例の集積状況は以下のとお
り。
アナフィラキシー関連の国内症
例を評価した。症例の因果関係
評価及び使用上の注意の改訂
要否について、専門委員の意見
も聴取した結果、本剤とアナフィ
ラキシーとの因果関係の否定で
きない症例は 1 例であるもの
の、異物である本剤に対するア
ナフィラキシーの発現は潜在的
リスクとして自明であり、緊急承
認品目として遅滞ない安全対策
措置が重要であると考えたこと
から、さらなる症例集積を待たず
に、使用上の注意を改訂するこ
とが適切と判断した。
アナフィラキシー関連症例*の国内
症例の集積状況は以下のとおり。
5 例(うち、医薬品と事象との因果
関係が否定できない症例 3 例)
【死亡 0 例】
*:医薬品医療機器総合機構に
おける副作用等報告データベー
スに登録された症例
改訂案
11. 副作用
11.1 重大な副作用
ループス様症候群
特に 6 ヵ月以上使用している長期投与例で多く報告されている。
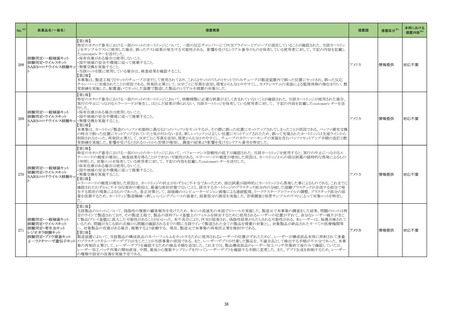
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂 (新記載要領)】
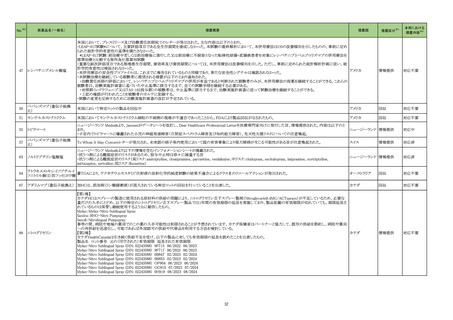
エンシトレルビル
フマル酸
ループス様症候群関連の国内症
例のうち本剤投与後に当該事象
が発現した症例及び公表文献
(Curr Drug Saf 2020; 16: 1-13、
Arch Inter Med 1999; 159: 493-7
等)を評価した。症例の因果関係
評価及び使用上の注意の改訂
要否について、専門委員の意見
も聴取した結果、本剤とループス
様症候群との因果関係の否定で
きない国内症例が集積したこと、
及び当該事象の発現は長期投
与例で多い傾向が認められたこ
とから、使用上の注意を改訂す
ることが適切と判断した。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
11. 副作用
11.1 重大な副作用
全身性紅斑性狼瘡(SLE)様症状の増悪
23-15
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
現行
11. 副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
アナフィラキシー
8
3 例(うち、医薬品と事象との因果
関係が否定できない症例 1 例)
【死亡 0 例】
*:医薬品医療機器総合機構に
おける副作用等報告データベー
スに登録された症例
一般名
薬効
分類
改訂内容
改訂理由
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
2314
ミノサイクリン塩酸
塩(経口剤、注射
剤)
615
主として
グラム
陽性・陰
性菌、リ
ケッチ
ア、クラ
ミジアに
作用す
るもの
現行
改訂案
副作用
重大な副作用
全身性紅斑性狼瘡(SLE)様症状の増悪:
全身性紅斑性狼瘡(SLE)様症状の増悪があらわれることがあるの
で、このような症状があらわれた場合には投与を中止し、適切な
処置を行うこと。
副作用
重大な副作用
ループス様症候群:
ループス様症候群があらわれることがあるので、このような症状
があらわれた場合には投与を中止し、適切な処置を行うこと。特
に 6 ヵ月以上使用している長期投与例で多く報告されている。
現行
625 抗
ウイル
ス剤
ループス様症候群関連症例*の国
内症例の集積状況は以下のとお
り。
アナフィラキシー関連の国内症
例を評価した。症例の因果関係
評価及び使用上の注意の改訂
要否について、専門委員の意見
も聴取した結果、本剤とアナフィ
ラキシーとの因果関係の否定で
きない症例は 1 例であるもの
の、異物である本剤に対するア
ナフィラキシーの発現は潜在的
リスクとして自明であり、緊急承
認品目として遅滞ない安全対策
措置が重要であると考えたこと
から、さらなる症例集積を待たず
に、使用上の注意を改訂するこ
とが適切と判断した。
アナフィラキシー関連症例*の国内
症例の集積状況は以下のとおり。
5 例(うち、医薬品と事象との因果
関係が否定できない症例 3 例)
【死亡 0 例】
*:医薬品医療機器総合機構に
おける副作用等報告データベー
スに登録された症例
改訂案
11. 副作用
11.1 重大な副作用
ループス様症候群
特に 6 ヵ月以上使用している長期投与例で多く報告されている。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂 (新記載要領)】
エンシトレルビル
フマル酸
ループス様症候群関連の国内症
例のうち本剤投与後に当該事象
が発現した症例及び公表文献
(Curr Drug Saf 2020; 16: 1-13、
Arch Inter Med 1999; 159: 493-7
等)を評価した。症例の因果関係
評価及び使用上の注意の改訂
要否について、専門委員の意見
も聴取した結果、本剤とループス
様症候群との因果関係の否定で
きない国内症例が集積したこと、
及び当該事象の発現は長期投
与例で多い傾向が認められたこ
とから、使用上の注意を改訂す
ることが適切と判断した。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
11. 副作用
11.1 重大な副作用
全身性紅斑性狼瘡(SLE)様症状の増悪
23-15
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
現行
11. 副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
アナフィラキシー
8
3 例(うち、医薬品と事象との因果
関係が否定できない症例 1 例)
【死亡 0 例】
*:医薬品医療機器総合機構に
おける副作用等報告データベー
スに登録された症例