よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
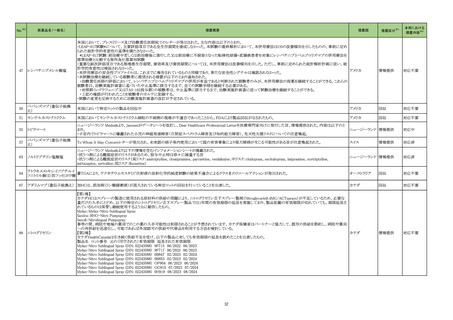
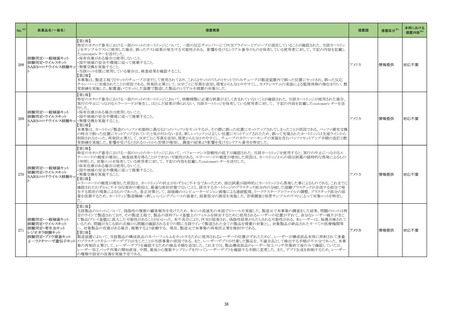
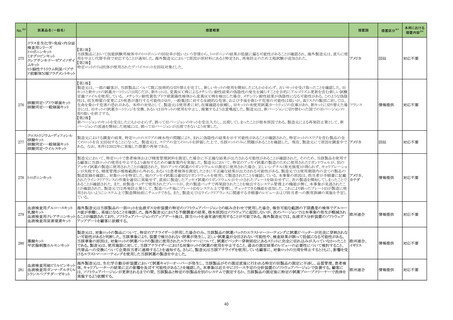
No.※2
医薬品名(一般名)
261 多項目免疫グロブリンキット
措置概要
措置国
当該製品の特定ロットの一部において、構成品の一部試薬が充填されていない不具合品が発見された。 調査の結果、製造の封止工程に問題があると判断された。当該
試薬は黄色で着色されているため、不具合品は目視で発見することが可能である。目視で不具合を発見できず使用した場合も、当該試薬に対する結果が得られないこと フランス
から検査エラーとして不具合を認識することができるため、患者へのリスクはないが、新たに検査を実施する必要がある。
措置区分※3
本邦における
措置内容※4
情報提供
対応不要
製造元における苦情調査の結果、特定ロットのブラジル流通用の当該製品において、誤ったラベルが表示されたことが判明した。 米国本社は、ブラジルにおいて、顧客
へ情報提供文書を提供し、以下の措置を通知するように伝達した。
-対象ロットの製品で誤ったラベルが表示されている場合、製品を廃棄すること。
-当該製品を他の施設へ提供した場合、情報提供文書を送付し、情報提供を行うこと。
B 型肝炎ウイルス e 抗原キッ
ブラジル、
262
-施設の手順に従い、情報提供文書を保管すること。
ト
アメリカ
調査の結果、当該事象はブラジル流通用のラベル表示を行う海外倉庫の作業者が誤って別の製品ラベルを割り当て、ラベル印刷機の確認で見逃したことにより発生した
ことが確認された。 更なる調査の結果、複数の情報を用いて製品ラベルへのラベル割り当てを行っていることが根本原因と特定された。
作業者による割り当ての間違いを防ぐために製品情報と工程情報を管理するラベル管理システムを導入する。また、作業手順書を変更し、ラベル貼付間違いの見逃しを
防ぐように作業者の責任を明確にした。
情報提供
対応不要
海外製造元は、患者尿検体および尿コルチゾールの品質管理結果が断続的に外れるという負のバイアスについて、顧客から報告があったことを確認した。海外製造元で
の調査にて、影響を受けたキットと受けていないキットのロット間の比較試験では尿検体において負のバイアスが認められた。海外製造元では現在根本原因調査を行って
欧州連合
いる。血清および血漿検体は本事象の影響を受けないため、血清および血漿検体におけるコルチゾールの測定には引き続き使用することが出来る。本事象はすべての
ロットに影響するため、追って通知があるまで当該製品を尿検体の測定には使用を控えるよう顧客に依頼する。
情報提供
対応中
情報提供
対応不要
回収
対応不要
情報提供
対応中
情報提供
対応不要
263 コルチゾールキット
核酸同定・一般細菌キット
核酸同定・ブドウ球菌キット
核酸同定・真菌キット
バンコマイシン耐性遺伝子
キット
米国における国内輸送の際に、対象製品を含む3種類の製品について、自然災害(ハリケーン)の発生による輸送遅延により、必要な温度仕様を逸脱して輸送されたた
264 β-ラクタマーゼ遺伝子キット め、使用期限が本来12ヶ月担保されているところ、製造日から6ヶ月に性能が低下する可能性があることがわかった。 対象製品は、米国内の医療機関等へ納品されてお
コリスチン耐性遺伝子キット
り、施設で対象製品が使用された場合、誤った結果が得られる可能性があるため、対象の医療機関等に、対象製品の使用を中止し、廃棄するよう依頼する。
核酸同定・ウイルスキット
SARSコロナウイルス核酸キッ
ト
核酸同定・寄生虫キット
核酸同定・一般細菌キット
核酸同定・ブドウ球菌キット
265
バンコマイシン耐性遺伝子
キット
266 グリコヘモグロビンA1cキット
血液検査用甲状腺ペルオキ
シダーゼ抗体キット
267
サイトメガロウイルス免疫グロ
ブリン M キット
アメリカ
製造元より、当該製品の特定ロットにおいて、コントロールチューブ内にペレットがない可能性があるため、自主回収を行うとの通知を受領した。 製造元は、対象製品及び
同様工程の製品の在庫品で、コントロールチューブのペレットの有無を確認し、対象ロットを特定した。 根本原因は、コントロールチューブ内の内容物(ペレット)の検査工
程がなく、また、QC試験において検査規格及び試験サンプルの数量についての記載がなかったためと考えられる。製造元における是正処置として、ユーティリティトレイ アメリカ
の包装工程で、コントロールチューブ及びその中のペレットの有無を全てのトレイについて確認する製造手順に改訂した。 また、QC試験で1ロットにつきユーティリティトレ
イ40個をサンプリングし、全てのトレイにコントロールチューブ及びその中のペレットが有ることを確認する試験手順に改訂した。
アメリカ、
当該製品で患者検体および精度管理試料を測定した場合に、一部の試薬で測定結果が偽高値または偽低値となる可能性があることが製造元で確認された。本事象は
イギリス、
精度管理試料を測定することで発見することができるが、気が付かずに患者検体の測定に使用された場合、誤った測定値が臨床に報告される可能性がある。製造元では
カナダ、
原因究明の調査を継続しているが、現在のところ原因の特定に至っていない。また、事象が確認されたロット以外の使用期限内の全ロットの調査が完了するまでの間は、
フランス、
本製品を使用する全ての顧客に対して、本事象の説明と対処方法について情報提供を実施した。なお、本事象回避のための対処については、今後製造されるロットにも
ドイツ、
適用される。
オーストラリア
製造元における分注工程時の誤設定により、特定ロットの対象製品で一部の構成試薬が添付文書に記載された容量より僅かに少ないことが確認された。試薬容量が僅か
に少ないことによる測定性能への影響はないことが確認されている。 製造元は、2製品の本問題について顧客へ文書により情報提供を行うことを決定した。海外製造所に
アメリカ、
おける調査の結果、当該事象は、分注量の設定を変更した際に作業者の人為的ミスにより製品情報シートに用いる質量(g)と体積(mL)の単位表記を誤ったことが原因と特
欧州連合、
定された。これにより、溶液の密度によっては試薬充填装置の分注量が僅かに減少した。また、設計変更で承認されたマスター情報の様式に単位表記がなかったことが、
イギリス、
マスター情報と照合して製品情報シートの検証を行った際に表記単位の誤りを検知できなかった一因と推察された。海外製造所で特定期間に分注量の設定を変更した
カナダ、
製品の設定値を調査した結果、設定値に誤りがあった製品ロットのうち、出荷された3製品が措置の対象に特定された。当該製品の分注量の設定値を修正し、次ロットの
オーストラリア
製造から正しい設定値で分注が行われている。また、是正措置としてマスター情報の様式に単位表記を追加した。さらに、分注量の設定値の変更は、上長が該当する設
計変更に基づき検証を行う手順に変更した。
37
医薬品名(一般名)
261 多項目免疫グロブリンキット
措置概要
措置国
当該製品の特定ロットの一部において、構成品の一部試薬が充填されていない不具合品が発見された。 調査の結果、製造の封止工程に問題があると判断された。当該
試薬は黄色で着色されているため、不具合品は目視で発見することが可能である。目視で不具合を発見できず使用した場合も、当該試薬に対する結果が得られないこと フランス
から検査エラーとして不具合を認識することができるため、患者へのリスクはないが、新たに検査を実施する必要がある。
措置区分※3
本邦における
措置内容※4
情報提供
対応不要
製造元における苦情調査の結果、特定ロットのブラジル流通用の当該製品において、誤ったラベルが表示されたことが判明した。 米国本社は、ブラジルにおいて、顧客
へ情報提供文書を提供し、以下の措置を通知するように伝達した。
-対象ロットの製品で誤ったラベルが表示されている場合、製品を廃棄すること。
-当該製品を他の施設へ提供した場合、情報提供文書を送付し、情報提供を行うこと。
B 型肝炎ウイルス e 抗原キッ
ブラジル、
262
-施設の手順に従い、情報提供文書を保管すること。
ト
アメリカ
調査の結果、当該事象はブラジル流通用のラベル表示を行う海外倉庫の作業者が誤って別の製品ラベルを割り当て、ラベル印刷機の確認で見逃したことにより発生した
ことが確認された。 更なる調査の結果、複数の情報を用いて製品ラベルへのラベル割り当てを行っていることが根本原因と特定された。
作業者による割り当ての間違いを防ぐために製品情報と工程情報を管理するラベル管理システムを導入する。また、作業手順書を変更し、ラベル貼付間違いの見逃しを
防ぐように作業者の責任を明確にした。
情報提供
対応不要
海外製造元は、患者尿検体および尿コルチゾールの品質管理結果が断続的に外れるという負のバイアスについて、顧客から報告があったことを確認した。海外製造元で
の調査にて、影響を受けたキットと受けていないキットのロット間の比較試験では尿検体において負のバイアスが認められた。海外製造元では現在根本原因調査を行って
欧州連合
いる。血清および血漿検体は本事象の影響を受けないため、血清および血漿検体におけるコルチゾールの測定には引き続き使用することが出来る。本事象はすべての
ロットに影響するため、追って通知があるまで当該製品を尿検体の測定には使用を控えるよう顧客に依頼する。
情報提供
対応中
情報提供
対応不要
回収
対応不要
情報提供
対応中
情報提供
対応不要
263 コルチゾールキット
核酸同定・一般細菌キット
核酸同定・ブドウ球菌キット
核酸同定・真菌キット
バンコマイシン耐性遺伝子
キット
米国における国内輸送の際に、対象製品を含む3種類の製品について、自然災害(ハリケーン)の発生による輸送遅延により、必要な温度仕様を逸脱して輸送されたた
264 β-ラクタマーゼ遺伝子キット め、使用期限が本来12ヶ月担保されているところ、製造日から6ヶ月に性能が低下する可能性があることがわかった。 対象製品は、米国内の医療機関等へ納品されてお
コリスチン耐性遺伝子キット
り、施設で対象製品が使用された場合、誤った結果が得られる可能性があるため、対象の医療機関等に、対象製品の使用を中止し、廃棄するよう依頼する。
核酸同定・ウイルスキット
SARSコロナウイルス核酸キッ
ト
核酸同定・寄生虫キット
核酸同定・一般細菌キット
核酸同定・ブドウ球菌キット
265
バンコマイシン耐性遺伝子
キット
266 グリコヘモグロビンA1cキット
血液検査用甲状腺ペルオキ
シダーゼ抗体キット
267
サイトメガロウイルス免疫グロ
ブリン M キット
アメリカ
製造元より、当該製品の特定ロットにおいて、コントロールチューブ内にペレットがない可能性があるため、自主回収を行うとの通知を受領した。 製造元は、対象製品及び
同様工程の製品の在庫品で、コントロールチューブのペレットの有無を確認し、対象ロットを特定した。 根本原因は、コントロールチューブ内の内容物(ペレット)の検査工
程がなく、また、QC試験において検査規格及び試験サンプルの数量についての記載がなかったためと考えられる。製造元における是正処置として、ユーティリティトレイ アメリカ
の包装工程で、コントロールチューブ及びその中のペレットの有無を全てのトレイについて確認する製造手順に改訂した。 また、QC試験で1ロットにつきユーティリティトレ
イ40個をサンプリングし、全てのトレイにコントロールチューブ及びその中のペレットが有ることを確認する試験手順に改訂した。
アメリカ、
当該製品で患者検体および精度管理試料を測定した場合に、一部の試薬で測定結果が偽高値または偽低値となる可能性があることが製造元で確認された。本事象は
イギリス、
精度管理試料を測定することで発見することができるが、気が付かずに患者検体の測定に使用された場合、誤った測定値が臨床に報告される可能性がある。製造元では
カナダ、
原因究明の調査を継続しているが、現在のところ原因の特定に至っていない。また、事象が確認されたロット以外の使用期限内の全ロットの調査が完了するまでの間は、
フランス、
本製品を使用する全ての顧客に対して、本事象の説明と対処方法について情報提供を実施した。なお、本事象回避のための対処については、今後製造されるロットにも
ドイツ、
適用される。
オーストラリア
製造元における分注工程時の誤設定により、特定ロットの対象製品で一部の構成試薬が添付文書に記載された容量より僅かに少ないことが確認された。試薬容量が僅か
に少ないことによる測定性能への影響はないことが確認されている。 製造元は、2製品の本問題について顧客へ文書により情報提供を行うことを決定した。海外製造所に
アメリカ、
おける調査の結果、当該事象は、分注量の設定を変更した際に作業者の人為的ミスにより製品情報シートに用いる質量(g)と体積(mL)の単位表記を誤ったことが原因と特
欧州連合、
定された。これにより、溶液の密度によっては試薬充填装置の分注量が僅かに減少した。また、設計変更で承認されたマスター情報の様式に単位表記がなかったことが、
イギリス、
マスター情報と照合して製品情報シートの検証を行った際に表記単位の誤りを検知できなかった一因と推察された。海外製造所で特定期間に分注量の設定を変更した
カナダ、
製品の設定値を調査した結果、設定値に誤りがあった製品ロットのうち、出荷された3製品が措置の対象に特定された。当該製品の分注量の設定値を修正し、次ロットの
オーストラリア
製造から正しい設定値で分注が行われている。また、是正措置としてマスター情報の様式に単位表記を追加した。さらに、分注量の設定値の変更は、上長が該当する設
計変更に基づき検証を行う手順に変更した。
37