よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
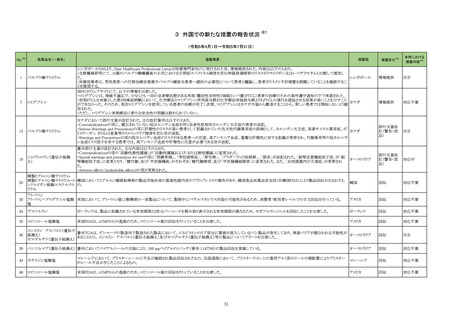
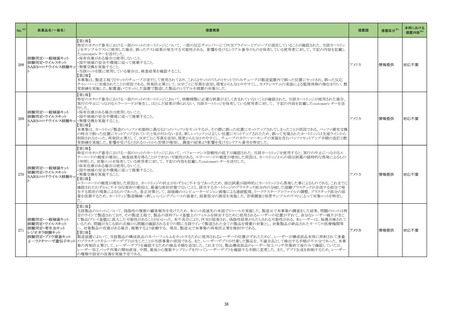
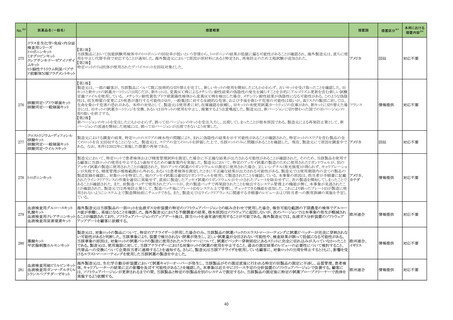
No.※2
医薬品名(一般名)
措置概要
措置国
措置区分※3
本邦における
措置内容※4
214 トピラマート
豪州TGAにおいて、製品情報に以下の内容が追記された。
・Contraindicationsの項に、妊娠中及び出産の可能性のある女性における片頭痛の予防への投与が追加。
・Special Warnings and Special Precautions for Useの項に、妊娠の可能性のある女性に対してトピラマートによる治療を開始する前に、妊娠検査を実施し、効果の高い避 オーストラリア
妊法を用いるべきである。患者には、妊娠中のトピラマート使用に関連するリスクを十分に説明すべきであると追記。
・Fertility, pregnancy and lactationの項に胎児神経発達障害(自閉症スペクトラム障害、知的障害等)が追記。
添付文書改
訂(警告・禁
忌)
対応中
215 ビガバトリン
【第1報】
サブリル散分包の原薬製造工場であるイタリアの Huvepharma Italia S.R.Lにおいて、ビガバトリンと同一製造ラインで製造されたチアプリドがビガバトリン原薬から微量検
出されたことに伴い、ヨルダンにてサブリル500mg錠の 2バッチをクラス1として自主回収を行う決定がなされた。
【第2報】
ヨルダン、
Huvepharma Italia S.R.Lで製造された原薬126バッチについて検査が行われた。分析の結果、検出限界0.3ppmを超えるチアプリドが25バッチで確認された。チアプリドが フランス、
検出された原薬が用いられた製剤(サブリル錠及びサブリル散)は合計45バッチであることが確認され、それらが流通している42か国において、各国の規制当局に対し自 イギリス
主回収に関するコミュニケーションを開始する。
【第3報】
フランス、イギリスで自主回収が開始された。
回収
対応中
227 ダカルバジン
構成直後(適切な調製及び保管後)に溶液が桃色に変色したため、特定のバッチをリコールしている。
イギリス
回収
対応不要
229 ニラパリブトシル酸塩水和物
海外で実施中のSCOOP試験213406(再発又は難治性の固形癌を有する小児患者を対象とした本剤及びdostarlimabの第1相試験)において、グレード3及び4の血小板
減少症の有害事象が報告されたことを踏まえ、当該試験への組み入れを一時中断する旨のレターを発出した。
イギリス
情報提供
対応済
230 トラマドール塩酸塩
米国FDAは、パッケージ欠陥のため、トラマドール塩酸塩錠50mgを自主回収していると公表した。
アメリカ
回収
対応不要
アメリカ
回収
対応不要
256 エゼチミブ
米国FDAは、エゼチミブの添付文書を改訂した。主な内容は以下のとおり。
Contraindicationsの項
①エゼチミブまたはエゼチミブに含まれる賦形剤に対する過敏症が知られている患者には禁忌である旨を追記する。
②スタチン、フェノフィブラートまたは他のLDL-C低下療法と併用する場合、エゼチミブは、スタチン、フェノフィブラートまたは他のLDL-C低下療法が禁忌である患者には
禁忌であることを追加する。
Warnings and Precautionsの項
③Risks Associated with Combination Treatment with a Statin, Fenofibrate, or Other LDL-C Lowering Therapiesの項に、他のLDL-C低下剤と併用する場合には、これら
の薬剤の処方情報を参照し、Warnings and Precautionsを含むがこれらに限定されないリスクについて説明することを追記する。
④Liver Enzymesの項に、血清トランスアミナーゼが増加する旨、肝機能検査を実施し、AST、ALTが施設基準値の3倍を超える場合は中止を検討する旨を追記する。
⑤Myopathy/Rhabdomyolysisの項に、ミオパシーの症状(クレアチンキナーゼ(CK)上昇に伴う筋肉痛、圧痛、脱力感)を追記し、ミオパシーが疑われる場合は、必要に応
じてエゼチミブ及び他の併用薬を中止することを追記する。
アメリカ
Adverse ReactionsのPostmarketing Reactionsの項に、以下を追記する。
⑥血液障害:血小板減少症
⑦胃腸障害:腹痛、膵炎、吐き気
⑧肝胆道障害:肝トランスアミナーゼ上昇、肝炎、 胆石症、胆嚢炎
⑨皮膚および皮下組織障害:多型紅斑
⑩Drug Interactionsの項をTable形式に記載変更する。
⑪Pregnancy及びLactationの項をPLRに基づき変更する。
⑫Pediatric Useの項に、エゼチミブの安全性と有効性は、HeFHまたは HoFHの10 歳未満の小児患者、ホモ接合性家族性シトステロール血症の9歳未満の小児患者、ま
たは他の種類の高脂血症の小児患者では確立されていない旨を追記する。
⑬Geriatric Useの項に、高齢者と若年成人とで薬物動態に差が認められなかった旨を追記する。
添付文書改
訂(警告・禁
忌)
注目
257 ニルマトレルビル・リトナビル
カナダ添付文書が改訂された。主な改訂は以下の通り。
・Contraindications の項に併用禁忌の薬剤として、シロドシン、エプレレノン、イバブラジン、エレトリプタン、Uogepant、フィネレノン、Nloxegol、Fibanserin、トルバプタン、中
止直後に本剤を開始してはいけないCYP3A誘導剤として、プリミドン、Lumacaftor/ivacaftorを追記。
・Drug interactionsの項の臨床的に重要な薬物相互作用のリストに、タムスロシン、Hydrocodone、オキシコドン、Meperidine、トラマドール、Propoxyphenea、メサドン、セリチ
ニブ、Ivosidenib、アピキサバン、ダビガトラン、クロナゼパム、エトスクシミド、Divalproex、ラモトリギン、Bupropion、イサブコナゾニウム硫酸塩、ボリコナゾール、エリスロマイ
カナダ
シン、アムロジピン、フェロジピン、ニカルジピン、アリスキレン、チカグレロル、Vorapaxar、クロピドグレル、サキサグリプチン、Elbasvir/grazoprevir、グレカプレビル・ピブレ
ンタスビル、Sofosbuvir/velpatasvir/voxilaprevir、ジドブジン、エムトリシタビン、ネビラピン、ビクテグラビル、シクロスポリン、タクロリムス、エベロリムス、シロリムス、
rapamycin、トファシチニブ、サルメテロール、darifenacin、クロザピン、スボレキサント、アリピプラゾール、ブレクスピプラゾール、Cariprazine、Iloperidone、Lumateperone、
pimavanserin、タダラフィルを追記。
・Adverse reactionsの項にアナフィラキシーと高血圧を追記。
添付文書改
訂(警告・禁
忌)
注目
沈降15価肺炎球菌結合型ワ
250 クチン(無毒性変異ジフテリア 米国において、シリンジ破損に関する苦情が増加したことにより、一部ロット(W021510、W021512、W027250、W021637、W028846)の自主回収が行われることとなった。
毒素結合体)
36
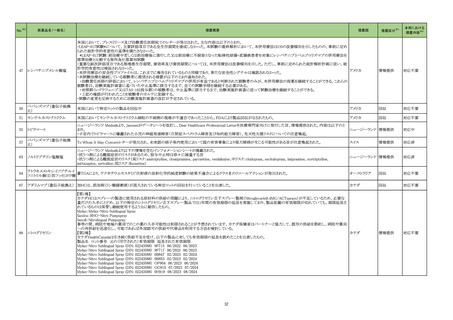
医薬品名(一般名)
措置概要
措置国
措置区分※3
本邦における
措置内容※4
214 トピラマート
豪州TGAにおいて、製品情報に以下の内容が追記された。
・Contraindicationsの項に、妊娠中及び出産の可能性のある女性における片頭痛の予防への投与が追加。
・Special Warnings and Special Precautions for Useの項に、妊娠の可能性のある女性に対してトピラマートによる治療を開始する前に、妊娠検査を実施し、効果の高い避 オーストラリア
妊法を用いるべきである。患者には、妊娠中のトピラマート使用に関連するリスクを十分に説明すべきであると追記。
・Fertility, pregnancy and lactationの項に胎児神経発達障害(自閉症スペクトラム障害、知的障害等)が追記。
添付文書改
訂(警告・禁
忌)
対応中
215 ビガバトリン
【第1報】
サブリル散分包の原薬製造工場であるイタリアの Huvepharma Italia S.R.Lにおいて、ビガバトリンと同一製造ラインで製造されたチアプリドがビガバトリン原薬から微量検
出されたことに伴い、ヨルダンにてサブリル500mg錠の 2バッチをクラス1として自主回収を行う決定がなされた。
【第2報】
ヨルダン、
Huvepharma Italia S.R.Lで製造された原薬126バッチについて検査が行われた。分析の結果、検出限界0.3ppmを超えるチアプリドが25バッチで確認された。チアプリドが フランス、
検出された原薬が用いられた製剤(サブリル錠及びサブリル散)は合計45バッチであることが確認され、それらが流通している42か国において、各国の規制当局に対し自 イギリス
主回収に関するコミュニケーションを開始する。
【第3報】
フランス、イギリスで自主回収が開始された。
回収
対応中
227 ダカルバジン
構成直後(適切な調製及び保管後)に溶液が桃色に変色したため、特定のバッチをリコールしている。
イギリス
回収
対応不要
229 ニラパリブトシル酸塩水和物
海外で実施中のSCOOP試験213406(再発又は難治性の固形癌を有する小児患者を対象とした本剤及びdostarlimabの第1相試験)において、グレード3及び4の血小板
減少症の有害事象が報告されたことを踏まえ、当該試験への組み入れを一時中断する旨のレターを発出した。
イギリス
情報提供
対応済
230 トラマドール塩酸塩
米国FDAは、パッケージ欠陥のため、トラマドール塩酸塩錠50mgを自主回収していると公表した。
アメリカ
回収
対応不要
アメリカ
回収
対応不要
256 エゼチミブ
米国FDAは、エゼチミブの添付文書を改訂した。主な内容は以下のとおり。
Contraindicationsの項
①エゼチミブまたはエゼチミブに含まれる賦形剤に対する過敏症が知られている患者には禁忌である旨を追記する。
②スタチン、フェノフィブラートまたは他のLDL-C低下療法と併用する場合、エゼチミブは、スタチン、フェノフィブラートまたは他のLDL-C低下療法が禁忌である患者には
禁忌であることを追加する。
Warnings and Precautionsの項
③Risks Associated with Combination Treatment with a Statin, Fenofibrate, or Other LDL-C Lowering Therapiesの項に、他のLDL-C低下剤と併用する場合には、これら
の薬剤の処方情報を参照し、Warnings and Precautionsを含むがこれらに限定されないリスクについて説明することを追記する。
④Liver Enzymesの項に、血清トランスアミナーゼが増加する旨、肝機能検査を実施し、AST、ALTが施設基準値の3倍を超える場合は中止を検討する旨を追記する。
⑤Myopathy/Rhabdomyolysisの項に、ミオパシーの症状(クレアチンキナーゼ(CK)上昇に伴う筋肉痛、圧痛、脱力感)を追記し、ミオパシーが疑われる場合は、必要に応
じてエゼチミブ及び他の併用薬を中止することを追記する。
アメリカ
Adverse ReactionsのPostmarketing Reactionsの項に、以下を追記する。
⑥血液障害:血小板減少症
⑦胃腸障害:腹痛、膵炎、吐き気
⑧肝胆道障害:肝トランスアミナーゼ上昇、肝炎、 胆石症、胆嚢炎
⑨皮膚および皮下組織障害:多型紅斑
⑩Drug Interactionsの項をTable形式に記載変更する。
⑪Pregnancy及びLactationの項をPLRに基づき変更する。
⑫Pediatric Useの項に、エゼチミブの安全性と有効性は、HeFHまたは HoFHの10 歳未満の小児患者、ホモ接合性家族性シトステロール血症の9歳未満の小児患者、ま
たは他の種類の高脂血症の小児患者では確立されていない旨を追記する。
⑬Geriatric Useの項に、高齢者と若年成人とで薬物動態に差が認められなかった旨を追記する。
添付文書改
訂(警告・禁
忌)
注目
257 ニルマトレルビル・リトナビル
カナダ添付文書が改訂された。主な改訂は以下の通り。
・Contraindications の項に併用禁忌の薬剤として、シロドシン、エプレレノン、イバブラジン、エレトリプタン、Uogepant、フィネレノン、Nloxegol、Fibanserin、トルバプタン、中
止直後に本剤を開始してはいけないCYP3A誘導剤として、プリミドン、Lumacaftor/ivacaftorを追記。
・Drug interactionsの項の臨床的に重要な薬物相互作用のリストに、タムスロシン、Hydrocodone、オキシコドン、Meperidine、トラマドール、Propoxyphenea、メサドン、セリチ
ニブ、Ivosidenib、アピキサバン、ダビガトラン、クロナゼパム、エトスクシミド、Divalproex、ラモトリギン、Bupropion、イサブコナゾニウム硫酸塩、ボリコナゾール、エリスロマイ
カナダ
シン、アムロジピン、フェロジピン、ニカルジピン、アリスキレン、チカグレロル、Vorapaxar、クロピドグレル、サキサグリプチン、Elbasvir/grazoprevir、グレカプレビル・ピブレ
ンタスビル、Sofosbuvir/velpatasvir/voxilaprevir、ジドブジン、エムトリシタビン、ネビラピン、ビクテグラビル、シクロスポリン、タクロリムス、エベロリムス、シロリムス、
rapamycin、トファシチニブ、サルメテロール、darifenacin、クロザピン、スボレキサント、アリピプラゾール、ブレクスピプラゾール、Cariprazine、Iloperidone、Lumateperone、
pimavanserin、タダラフィルを追記。
・Adverse reactionsの項にアナフィラキシーと高血圧を追記。
添付文書改
訂(警告・禁
忌)
注目
沈降15価肺炎球菌結合型ワ
250 クチン(無毒性変異ジフテリア 米国において、シリンジ破損に関する苦情が増加したことにより、一部ロット(W021510、W021512、W027250、W021637、W028846)の自主回収が行われることとなった。
毒素結合体)
36