よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
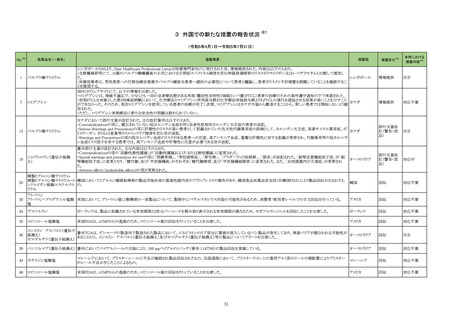
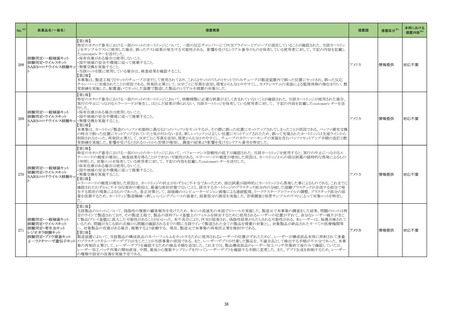
No.※2
23-29
一般名
アデノシン
薬効
分類
799
他に分
類され
ない治
療を主
目的とし
ない医
薬品
改訂内容
改訂理由
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
現行
改訂案
副作用
副作用
重大な副作用
重大な副作用
(新設)
アナフィラキシー:
アナフィラキシーショックに至った例も報告されている。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
11. 副作用
11.1 重大な副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
アナフィラキシー
アナフィラキシーショックに至った例も報告されている。
アナフィラキシー関連症例を評
価した。症例の因果関係評価及
び使用上の注意の改訂要否に
ついて、専門委員の意見も聴取
した結果、本剤とアナフィラキシ
ーとの因果関係が否定できない
症例が集積したことから、使用上
の注意を改訂することが適切と
判断した。
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
アナフィラキシー関連症例*の集積
状況は以下のとおり。
国内症例
6 例(うち、医薬品と事象との因果
関係が否定できない症例 4 例)
【死亡 0 例】
海外症例
6 例(うち、医薬品と事象との因果
関係が否定できない症例 2 例)
【死亡 1 例(うち、医薬品と事象に
よる死亡との因果関係が否定でき
ない症例 0 例)】
*:医薬品医療機器総合機構に
おける副作用等報告データベース
に登録された症例
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
現行
禁忌(次の患者には投与しないこと)
消化性潰瘍のある患者〔症状が悪化するおそれがある。〕
改訂案
禁忌(次の患者には投与しないこと)
(削除)
重篤な血液の異常のある患者〔重篤な転帰をとるおそれがある。〕 (削除)
重篤な腎障害のある患者〔重篤な転帰をとるおそれがある。〕
(削除)
重篤な心機能不全のある患者〔循環系のバランスが損なわれ、心 (削除)
不全が増悪するおそれがある。〕
アスピリン喘息(非ステロイド性消炎鎮痛剤による喘息発作の誘
(削除)
発)又はその既往歴のある患者〔アスピリン喘息の発症にプロスタ
グランジン合成阻害作用が関与していると考えられる。〕
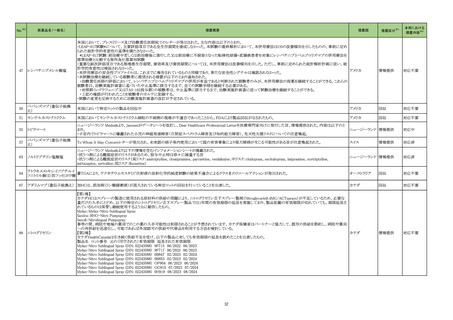
23-30
アセトアミノフェン
(経口
114
解熱鎮
痛消炎
剤
用法・用量に関連する使用上の注意
(新設)
用法・用量に関連する使用上の注意
アスピリン喘息又はその既往歴のある患者に対する 1 回あたりの
最大用量はアセトアミノフェンとして 300mg 以下とすること。
慎重投与(次の患者には慎重に投与すること)
慎重投与(次の患者には慎重に投与すること)
消化性潰瘍の既往歴のある患者〔消化性潰瘍の再発を促すおそれ 消化性潰瘍又はその既往歴のある患者〔症状が悪化又は再発を
がある。〕
促すおそれがある。〕
血液の異常又はその既往歴のある患者〔血液障害を起こすおそれ
がある。〕
血液の異常又はその既往歴のある患者〔症状が悪化又は再発を
促すおそれがある。〕
腎障害又はその既往歴のある患者〔腎機能が悪化するおそれがあ
る。〕
腎障害又はその既往歴のある患者〔投与量の減量、投与間隔の延
長を考慮すること。症状が悪化又は再発を促すおそれがある。〕
心機能異常のある患者〔症状が悪化するおそれがある。〕
心機能異常のある患者〔症状が悪化又は心不全が増悪するおそれ
がある。〕
(新設)
アスピリン喘息(非ステロイド性消炎鎮痛剤による喘息発作の誘
18
※調査結果報告書
(https://www.pmda.go.jp/files/000264874.pdf)参照
23-29
一般名
アデノシン
薬効
分類
799
他に分
類され
ない治
療を主
目的とし
ない医
薬品
改訂内容
改訂理由
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
現行
改訂案
副作用
副作用
重大な副作用
重大な副作用
(新設)
アナフィラキシー:
アナフィラキシーショックに至った例も報告されている。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
11. 副作用
11.1 重大な副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
アナフィラキシー
アナフィラキシーショックに至った例も報告されている。
アナフィラキシー関連症例を評
価した。症例の因果関係評価及
び使用上の注意の改訂要否に
ついて、専門委員の意見も聴取
した結果、本剤とアナフィラキシ
ーとの因果関係が否定できない
症例が集積したことから、使用上
の注意を改訂することが適切と
判断した。
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
アナフィラキシー関連症例*の集積
状況は以下のとおり。
国内症例
6 例(うち、医薬品と事象との因果
関係が否定できない症例 4 例)
【死亡 0 例】
海外症例
6 例(うち、医薬品と事象との因果
関係が否定できない症例 2 例)
【死亡 1 例(うち、医薬品と事象に
よる死亡との因果関係が否定でき
ない症例 0 例)】
*:医薬品医療機器総合機構に
おける副作用等報告データベース
に登録された症例
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
現行
禁忌(次の患者には投与しないこと)
消化性潰瘍のある患者〔症状が悪化するおそれがある。〕
改訂案
禁忌(次の患者には投与しないこと)
(削除)
重篤な血液の異常のある患者〔重篤な転帰をとるおそれがある。〕 (削除)
重篤な腎障害のある患者〔重篤な転帰をとるおそれがある。〕
(削除)
重篤な心機能不全のある患者〔循環系のバランスが損なわれ、心 (削除)
不全が増悪するおそれがある。〕
アスピリン喘息(非ステロイド性消炎鎮痛剤による喘息発作の誘
(削除)
発)又はその既往歴のある患者〔アスピリン喘息の発症にプロスタ
グランジン合成阻害作用が関与していると考えられる。〕
23-30
アセトアミノフェン
(経口
114
解熱鎮
痛消炎
剤
用法・用量に関連する使用上の注意
(新設)
用法・用量に関連する使用上の注意
アスピリン喘息又はその既往歴のある患者に対する 1 回あたりの
最大用量はアセトアミノフェンとして 300mg 以下とすること。
慎重投与(次の患者には慎重に投与すること)
慎重投与(次の患者には慎重に投与すること)
消化性潰瘍の既往歴のある患者〔消化性潰瘍の再発を促すおそれ 消化性潰瘍又はその既往歴のある患者〔症状が悪化又は再発を
がある。〕
促すおそれがある。〕
血液の異常又はその既往歴のある患者〔血液障害を起こすおそれ
がある。〕
血液の異常又はその既往歴のある患者〔症状が悪化又は再発を
促すおそれがある。〕
腎障害又はその既往歴のある患者〔腎機能が悪化するおそれがあ
る。〕
腎障害又はその既往歴のある患者〔投与量の減量、投与間隔の延
長を考慮すること。症状が悪化又は再発を促すおそれがある。〕
心機能異常のある患者〔症状が悪化するおそれがある。〕
心機能異常のある患者〔症状が悪化又は心不全が増悪するおそれ
がある。〕
(新設)
アスピリン喘息(非ステロイド性消炎鎮痛剤による喘息発作の誘
18
※調査結果報告書
(https://www.pmda.go.jp/files/000264874.pdf)参照