よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
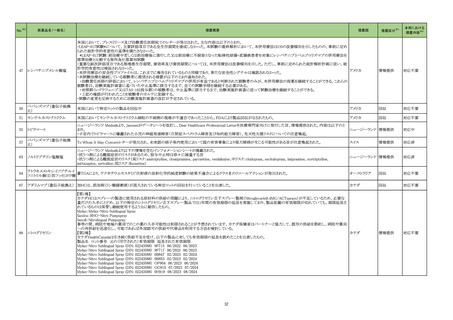
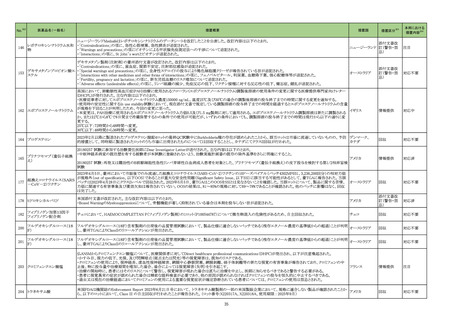
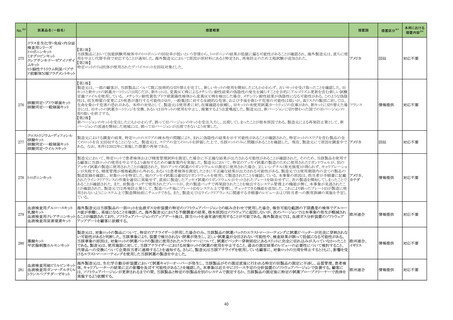
No.※2
医薬品名(一般名)
措置概要
措置国
措置区分※3
本邦における
措置内容※4
【第1報】
当該製品の1ロットについて、偽陰性の複数の顧客報告を受けたため、本ロット流通先の米国でリコールを実施した。製造元で本事象の調査をした結果、問題のロットは特
定のラインで製造されており、その製造工程で、製品の原料アレイ基盤上のフィルムを除去するために使用されるレーザーの位置がずれて、余分なレーザー破片が生じ
て製品(アレイ基盤)に混入した可能性があることがわかった。本不具合により、PCRが阻害され、偽陰性結果がもたらされる可能性がある。本レーザーは、毎週点検されて
核酸同定・一般細菌キット
いるため、問題が生じる前の点検から問題が確認されるまでの間に当該ラインで製造された全ての製品を措置の対象とし、対象製品が納品されたすべての医療機関等
核酸同定・ウイルスキット
へ、対象製品の在庫がある場合、廃棄するよう依頼する。 現在、製造元で本事象の再発防止策を検討中である。
272
アメリカ
SARSコロナウイルス核酸キッ 【第2報】
ト
製造装置において、当該製品の構成部品のカバーフィルムをカットするために使用されるレーザーの位置がずれたために、レーザーが構成部品本体に照射されて多量
のプラスチック片(レーザーデブリ)が生じたことが当該事象の原因である。また、レーザーデブリが付着した製品を、不適合品として検出する手順が不十分であった。本事
象の再発防止策として、レーザーデブリを確認するための検品手順を追加した。これまでは、製品構成部品のレーザー加工バッチ作業終了後のみで確認していたが、
レーザー加工バッチ作業の開始直後、中間、最後から複数サンプリングを行ってレーザーデブリを確認する手順に変更した。また、デブリ生成を抑制するため、レーザー
の種類や設定の改善を実施予定である。
情報提供
対応不要
【第1報】
製造元において、当該製品の特定ロットについて、ブロッキング試薬の濃度が不足していることが確認された。 検体中に含まれる干渉物質が十分に遮断されていないこと
によって引き起こされる、再現性のある偽高値の結果を示した。 製造元による社内調査の結果、患者検体の約5%以下が当該不具合の影響を受けることが確認された。 当
該試薬で検査した患者検体の測定結果は、約20~40%高くなる可能性がある。また、この増加の程度は検体中に存在する干渉物質の量により異なる可能性がある。 誤っ
た高いp2PSAの測定結果を用いて計算されたプロステートヘルスインデックスも同様に偽高値となる。これは、前立腺癌と前立腺の良性疾患との鑑別において、臨床的特
異性が低下する可能性があり、これにより不必要なフォローアップ検査や前立腺生検が行われる可能性があるが、精度管理用試料測定の結果には影響がない。 製造元
は、当該ロットの販売を中止し、以下の内容について、顧客への情報提供を実施する。
・当該製品の使用を中止し、対象ロットの残りの試薬パックは全て廃棄すること。
・過去の測定結果のレビューが必要かどうか、本通知文を検査室とメディカルダイレクターに共有することを推奨すること。
アメリカ、
273 前立腺特異抗原前駆体キット ・代替品への交換については、担当者へ連絡すること。
欧州連合
【第2報】
当該不具合の根本原因は、充填製造所の製造工程におけるオペレーターによる作業の誤りであると特定した。緩衝液調製におけるブロッキング剤必要量の算出と記録を
行うワークシートの入力に誤りがあり、ブロッキング剤の添加量が正しく計算されずに緩衝液が調製され、当該試薬パックが製造されたことが原因と特定した。当該担当オ
ペレーターが手順に従わなかったことが直接原因であり、さらに検証者による濃度の確認要件について手順の記載が不適切であったため、オペレーターの入力内容に依
存して確認を実施したことが、当該事象の原因と考えられる。製造元において、以下の3点を再発予防策として実施する。
1)手順書を更新し、検証者による濃度の確認要件を明確に手順に含める。
2)原料の使用時点で濃度情報を利用できるようにするため、原料試薬の試験成績書を記録に含める事を要求するよう関連手順を更新するか、あるいは原料濃度情報を
基幹システムを利用して保存する。
3)業務作業手順を改訂し、濃度を含む全ての情報を確認するためのレビュープロセスが明確になるよう変更する。
情報提供
対応不要
クラスⅡ免疫検査用シリーズ
抗デオキシリボ核酸抗体キット
抗リボ核蛋白抗体キット
抗SS-A/Ro抗体キット
抗SS-B抗体/La抗体キット
抗核抗体・抗セントロメア抗体
キット
抗Jo-1抗体キット
シトルリン化抗原に対する抗
当該製品を使用した測定において、偽陽性が発生するとの報告が海外製造元に入ったことから、調査が実施された。その結果、当該製品のウェルに使用しているコーティ
体キット
ング溶液(抗原を含まない)に含まれるBSAに対する非特異的な反応により偽陽性が発生することが判明した。海外製造元は、CAPAを立案し、顧客に対し、カットオフ値を
274 抗GBM抗体キット
スウェーデン
超えた検体について、他法で測定するよう周知した。当該事象については製造元のDfuに記載がある。
プロテイナーゼ3-抗好中球細
胞質自己抗体キット
ミエロペルオキシダーゼ抗好
中球細胞質自己抗体キット
抗カルジオリピンベータ2グリ
コプロテインⅠ複合体抗体
キット
抗Sm抗体キット
抗デオキシリボ核酸抗体キット
抗Scl-70抗体キット
情報提供
対応不要
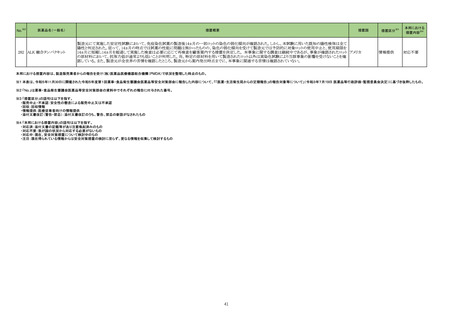
39
医薬品名(一般名)
措置概要
措置国
措置区分※3
本邦における
措置内容※4
【第1報】
当該製品の1ロットについて、偽陰性の複数の顧客報告を受けたため、本ロット流通先の米国でリコールを実施した。製造元で本事象の調査をした結果、問題のロットは特
定のラインで製造されており、その製造工程で、製品の原料アレイ基盤上のフィルムを除去するために使用されるレーザーの位置がずれて、余分なレーザー破片が生じ
て製品(アレイ基盤)に混入した可能性があることがわかった。本不具合により、PCRが阻害され、偽陰性結果がもたらされる可能性がある。本レーザーは、毎週点検されて
核酸同定・一般細菌キット
いるため、問題が生じる前の点検から問題が確認されるまでの間に当該ラインで製造された全ての製品を措置の対象とし、対象製品が納品されたすべての医療機関等
核酸同定・ウイルスキット
へ、対象製品の在庫がある場合、廃棄するよう依頼する。 現在、製造元で本事象の再発防止策を検討中である。
272
アメリカ
SARSコロナウイルス核酸キッ 【第2報】
ト
製造装置において、当該製品の構成部品のカバーフィルムをカットするために使用されるレーザーの位置がずれたために、レーザーが構成部品本体に照射されて多量
のプラスチック片(レーザーデブリ)が生じたことが当該事象の原因である。また、レーザーデブリが付着した製品を、不適合品として検出する手順が不十分であった。本事
象の再発防止策として、レーザーデブリを確認するための検品手順を追加した。これまでは、製品構成部品のレーザー加工バッチ作業終了後のみで確認していたが、
レーザー加工バッチ作業の開始直後、中間、最後から複数サンプリングを行ってレーザーデブリを確認する手順に変更した。また、デブリ生成を抑制するため、レーザー
の種類や設定の改善を実施予定である。
情報提供
対応不要
【第1報】
製造元において、当該製品の特定ロットについて、ブロッキング試薬の濃度が不足していることが確認された。 検体中に含まれる干渉物質が十分に遮断されていないこと
によって引き起こされる、再現性のある偽高値の結果を示した。 製造元による社内調査の結果、患者検体の約5%以下が当該不具合の影響を受けることが確認された。 当
該試薬で検査した患者検体の測定結果は、約20~40%高くなる可能性がある。また、この増加の程度は検体中に存在する干渉物質の量により異なる可能性がある。 誤っ
た高いp2PSAの測定結果を用いて計算されたプロステートヘルスインデックスも同様に偽高値となる。これは、前立腺癌と前立腺の良性疾患との鑑別において、臨床的特
異性が低下する可能性があり、これにより不必要なフォローアップ検査や前立腺生検が行われる可能性があるが、精度管理用試料測定の結果には影響がない。 製造元
は、当該ロットの販売を中止し、以下の内容について、顧客への情報提供を実施する。
・当該製品の使用を中止し、対象ロットの残りの試薬パックは全て廃棄すること。
・過去の測定結果のレビューが必要かどうか、本通知文を検査室とメディカルダイレクターに共有することを推奨すること。
アメリカ、
273 前立腺特異抗原前駆体キット ・代替品への交換については、担当者へ連絡すること。
欧州連合
【第2報】
当該不具合の根本原因は、充填製造所の製造工程におけるオペレーターによる作業の誤りであると特定した。緩衝液調製におけるブロッキング剤必要量の算出と記録を
行うワークシートの入力に誤りがあり、ブロッキング剤の添加量が正しく計算されずに緩衝液が調製され、当該試薬パックが製造されたことが原因と特定した。当該担当オ
ペレーターが手順に従わなかったことが直接原因であり、さらに検証者による濃度の確認要件について手順の記載が不適切であったため、オペレーターの入力内容に依
存して確認を実施したことが、当該事象の原因と考えられる。製造元において、以下の3点を再発予防策として実施する。
1)手順書を更新し、検証者による濃度の確認要件を明確に手順に含める。
2)原料の使用時点で濃度情報を利用できるようにするため、原料試薬の試験成績書を記録に含める事を要求するよう関連手順を更新するか、あるいは原料濃度情報を
基幹システムを利用して保存する。
3)業務作業手順を改訂し、濃度を含む全ての情報を確認するためのレビュープロセスが明確になるよう変更する。
情報提供
対応不要
クラスⅡ免疫検査用シリーズ
抗デオキシリボ核酸抗体キット
抗リボ核蛋白抗体キット
抗SS-A/Ro抗体キット
抗SS-B抗体/La抗体キット
抗核抗体・抗セントロメア抗体
キット
抗Jo-1抗体キット
シトルリン化抗原に対する抗
当該製品を使用した測定において、偽陽性が発生するとの報告が海外製造元に入ったことから、調査が実施された。その結果、当該製品のウェルに使用しているコーティ
体キット
ング溶液(抗原を含まない)に含まれるBSAに対する非特異的な反応により偽陽性が発生することが判明した。海外製造元は、CAPAを立案し、顧客に対し、カットオフ値を
274 抗GBM抗体キット
スウェーデン
超えた検体について、他法で測定するよう周知した。当該事象については製造元のDfuに記載がある。
プロテイナーゼ3-抗好中球細
胞質自己抗体キット
ミエロペルオキシダーゼ抗好
中球細胞質自己抗体キット
抗カルジオリピンベータ2グリ
コプロテインⅠ複合体抗体
キット
抗Sm抗体キット
抗デオキシリボ核酸抗体キット
抗Scl-70抗体キット
情報提供
対応不要
39