よむ、つかう、まなぶ。
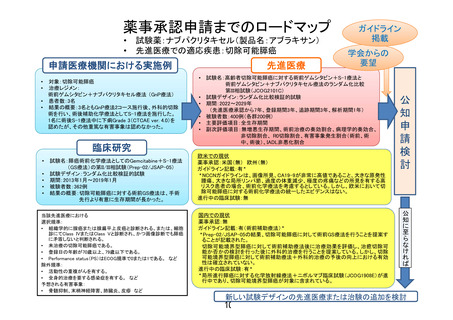
資料8 先進医療合同会議の審議結果について【報告事項】 (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27778.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第139回 9/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
CRF の締め切り日に従って報告する。
1)追跡調査時の転帰確認
生存確認は患者本人の外来受診の他、患者への電話連絡による生存確認も可。ただし
電話連絡による生存確認を行った場合は、そのことを診療録に記録すること。全生存期
間のイベントの取り扱いについての詳細は「11.3.1. 全生存期間」参照。
2)追跡調査時の増悪の確認
増悪の有無の確認は画像検査や検体検査による増悪の有無の確認は必須とせず、外
来診察等での臨床的な確認でよい。ただし、患者本人への電話連絡による確認のみは不
可とする。転院先または紹介先の医療機関などで増悪や無増悪についての情報が得ら
れた場合は、診断の根拠が記載された診療情報提供書を受け取り保管、またはメール等
で確認し、診療録に記録すること。この場合も電話連絡のみは不可とする。
無増悪生存期間のイベントの取り扱いについての詳細は「11.3.2. 無増悪生存期間」
参照。
《統計学的事項》
統計解析に関する方法は以下に定める。なお、具体的な解析を実施する際に必要とな
る詳細な事項は、解析に先だって別途作成する統計解析計画書、エンドポイント定義を
明示した文書等に定める。以下に定める統計解析に関する事項に実質的な変更が生じる
場合には、
「13.7. プロトコールの内容変更について」に定める方針に従う。なお、欠損
値や異常データ等については「14.1. 定期モニタリング」により施設に問い合わせを行
い、データの採否に関しては、
「14.1.2. 適格性(適格・不適格)
」および「14.1.3. プ
ロトコール逸脱・違反」に定める方針に従い、施設への問い合わせの結果に基づく研究
事務局による検討を経て決定する。「11. 効果判定とエンドポイントの定義」ならびに
「12. 統計学的事項」の以下に定める、各エンドポイントの定義・解析方法で対処でき
ない欠損値や異常データ等の取り扱いは、前述の統計解析計画書に定める。
主たる解析と判断規準
試験結果の主たる判断規準
本試験は主たる解析が最終解析となる。
登録終了 3 年後を目処に行う、本試験の primary endpoint に関する主たる解析の目的
は、標準治療群である A 群(術前 GS 療法)に対し、試験治療群である B 群(術前 GnP 療
法)が、primary endpoint である全生存期間において上回るかどうかを検証することで
ある。
試験治療群が標準治療群を統計学的に有意に上回った場合、試験治療である術前 GnP
療法がより有用な治療法であると結論する。有意に上回らなかった場合は、標準治療で
ある術前 GS 療法が引き続き有用な治療法であると結論する。
なお、12.2.-12.4 に記載する各エンドポイントの解析方法の詳細は、中間解析の手順
の詳細も含め、データセンターの当該グループ担当統計スタッフが検証的な解析を実施
する前に統計解析計画書に記載する。
23
1)追跡調査時の転帰確認
生存確認は患者本人の外来受診の他、患者への電話連絡による生存確認も可。ただし
電話連絡による生存確認を行った場合は、そのことを診療録に記録すること。全生存期
間のイベントの取り扱いについての詳細は「11.3.1. 全生存期間」参照。
2)追跡調査時の増悪の確認
増悪の有無の確認は画像検査や検体検査による増悪の有無の確認は必須とせず、外
来診察等での臨床的な確認でよい。ただし、患者本人への電話連絡による確認のみは不
可とする。転院先または紹介先の医療機関などで増悪や無増悪についての情報が得ら
れた場合は、診断の根拠が記載された診療情報提供書を受け取り保管、またはメール等
で確認し、診療録に記録すること。この場合も電話連絡のみは不可とする。
無増悪生存期間のイベントの取り扱いについての詳細は「11.3.2. 無増悪生存期間」
参照。
《統計学的事項》
統計解析に関する方法は以下に定める。なお、具体的な解析を実施する際に必要とな
る詳細な事項は、解析に先だって別途作成する統計解析計画書、エンドポイント定義を
明示した文書等に定める。以下に定める統計解析に関する事項に実質的な変更が生じる
場合には、
「13.7. プロトコールの内容変更について」に定める方針に従う。なお、欠損
値や異常データ等については「14.1. 定期モニタリング」により施設に問い合わせを行
い、データの採否に関しては、
「14.1.2. 適格性(適格・不適格)
」および「14.1.3. プ
ロトコール逸脱・違反」に定める方針に従い、施設への問い合わせの結果に基づく研究
事務局による検討を経て決定する。「11. 効果判定とエンドポイントの定義」ならびに
「12. 統計学的事項」の以下に定める、各エンドポイントの定義・解析方法で対処でき
ない欠損値や異常データ等の取り扱いは、前述の統計解析計画書に定める。
主たる解析と判断規準
試験結果の主たる判断規準
本試験は主たる解析が最終解析となる。
登録終了 3 年後を目処に行う、本試験の primary endpoint に関する主たる解析の目的
は、標準治療群である A 群(術前 GS 療法)に対し、試験治療群である B 群(術前 GnP 療
法)が、primary endpoint である全生存期間において上回るかどうかを検証することで
ある。
試験治療群が標準治療群を統計学的に有意に上回った場合、試験治療である術前 GnP
療法がより有用な治療法であると結論する。有意に上回らなかった場合は、標準治療で
ある術前 GS 療法が引き続き有用な治療法であると結論する。
なお、12.2.-12.4 に記載する各エンドポイントの解析方法の詳細は、中間解析の手順
の詳細も含め、データセンターの当該グループ担当統計スタッフが検証的な解析を実施
する前に統計解析計画書に記載する。
23