よむ、つかう、まなぶ。
【資料4-1】医薬・生活衛生局からの定期報告 (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
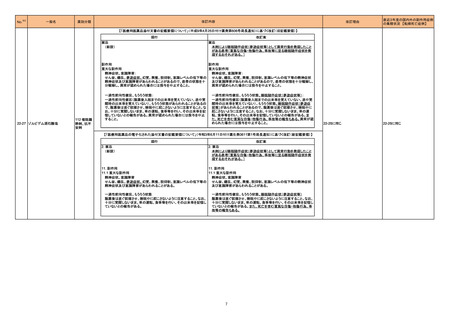
※2
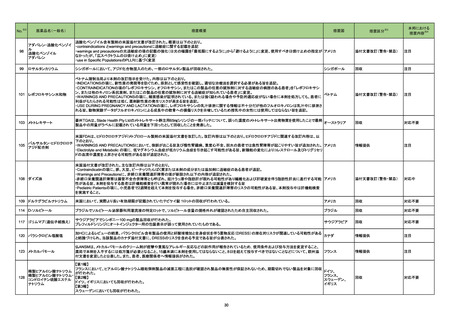
No.
医薬品名(一般名)
措置概要
※3
措置国
措置区分
本邦における
措置内容※4
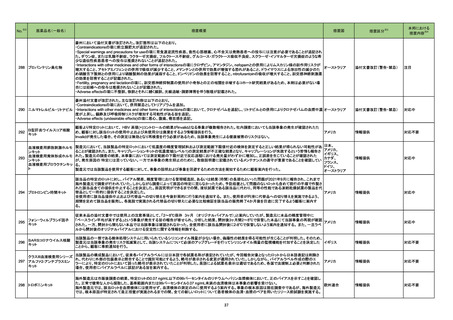
フルチカゾンフランカルボン
酸エステル
フルチカゾンフランカルボン
酸エステル・ウメクリジニウム
臭化物・ビランテロールトリ
マラウイにおいて、Avamys Nasal Spray、Ventolin 100 μg Inhaler、Zentel 400に対し、第三者である流通業者の流通チェーンで確認された温度監視装置の
262 フェニル酢酸塩
マラウイ
ビランテロールトリフェニル酢 喪失を理由としてグラクソ・スミスクライン南アフリカによる自主回収が行われた。
酸塩・フルチカゾンフランカル
ボン酸エステル
アルベンダゾール
サルブタモール硫酸塩
回収
対応不要
263 腹膜透析液
コロンビアで製造された腹膜透析液の特定ロットについて、液漏れが確認されたことから自主回収が行われた。
コロンビア
回収
対応不要
271 アルプラゾラム
パキスタンで、偽造品が発見されたため該当ロットの回収が行われた。
パキスタン
回収
対応不要
273 イトラコナゾール
豪州添付文書が改訂され、Interactions with other medicines and other forms of interactionsの項に以下が追記された。
・イトラコナゾール使用中および使用終了後2週間は、エドキサバン、glasdegib、talazoparibの使用を推奨しない
オーストラリア
・トレチノイン(経口)と併用する際は、抗悪性腫瘍薬の副作用を監視すること、抗悪性腫瘍薬の減量が必要となるかもしれない
・慢性リンパ性白血病/小リンパ球性リンパ腫でベネトクラクス投与開始/用量漸増期の患者は禁忌。それ以外は、イトラコナゾール使用中および使用終了後2
週間は、ベネトクラクスの使用を推奨しない
添付文書改訂(警告・禁忌)
対応済
276 エナラプリルマレイン酸塩
米国FDAは、詳細不明の不純物のため一部のエナラプリル製剤が自主回収されたことを公表した。
回収
対応不要
回収
対応不要
添付文書改訂(警告・禁忌)
注目
スイス
情報提供
注目
オーストラリア
添付文書改訂(警告・禁忌)
対応中
278
レボノルゲストレル・エチニル
エストラジオール
ドイツで、海外企業のレボノルゲストレル・エチニルエストラジオール製剤の特定バッチについて、ブリスターの印刷に誤りがあり、誤った服用順序に導くおそれ
ドイツ
ノルエチステロン・エチニルエ があるため自主回収を行った。
ストラジオール
284 クロルプロマジン塩酸塩
286
アメリカ
豪州添付文書が改訂された。主な改訂箇所は以下のとおり。
・Contraindicationsの項にフェノチアジン系化合物と乳児突然死症候群との関連が示唆されたため、1歳未満の小児が追加された。
・Special warnings and precautions for useの項の自殺、老人、小児、過敏症、肝機能及び腎機能障害患者(投与が推奨されないこと)、離脱症状、糖不耐症
(シロップ剤は糖不耐症患者には推奨されないこと)、無顆粒球症、悪性症候群に関する注意喚起が更新された。
オーストラリア
・Fertility, pregnancy and lactationの項に分娩時(分娩の遅延が生じることがあること)及び新生児における神経障害についての注意喚起が追加された。
・Effects on ability to drive and use machinesの項が更新され、めまい等があらわれることがあるため、本剤の投与開始初期(本剤の影響について明らかに
なるまで)は運転をしないように注意喚起された。
・Adverse effects、Overdoseの項に神経系及び心血管系の事象が追加された。
アテゾリズマブ(遺伝子組換 治験医師宛に情報が発出された。主な内容は以下のとおり。
え)
・免疫関連心膜障害(心膜炎、心嚢液貯留、心タンポナーデ等)が、重要な特定されたリスクに追加された。
豪州添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に「重度の腎機能障害患者、高カルシウム血症の患者、代謝性骨疾患の患者、原因不明のアルカリホスファターゼ上昇を示す患者、
287 テリパラチド(遺伝子組換え) 過去に骨への放射線照射を受けた患者、骨格系悪性腫瘍又は骨転移の患者、妊婦又は授乳婦」が追記された。
・Special warnings and precautions for useの項に中等度腎機能障害患者に対する注意喚起が追記された。
・Adverse Reactionsの項に貧血、腎不全、腎機能障害が追記された。
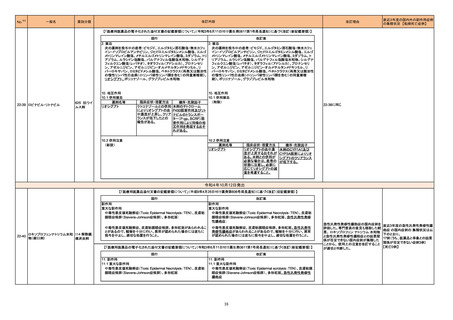
36
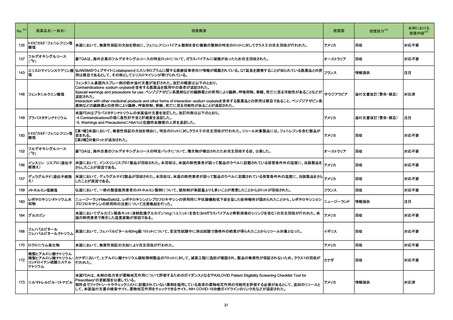
No.
医薬品名(一般名)
措置概要
※3
措置国
措置区分
本邦における
措置内容※4
フルチカゾンフランカルボン
酸エステル
フルチカゾンフランカルボン
酸エステル・ウメクリジニウム
臭化物・ビランテロールトリ
マラウイにおいて、Avamys Nasal Spray、Ventolin 100 μg Inhaler、Zentel 400に対し、第三者である流通業者の流通チェーンで確認された温度監視装置の
262 フェニル酢酸塩
マラウイ
ビランテロールトリフェニル酢 喪失を理由としてグラクソ・スミスクライン南アフリカによる自主回収が行われた。
酸塩・フルチカゾンフランカル
ボン酸エステル
アルベンダゾール
サルブタモール硫酸塩
回収
対応不要
263 腹膜透析液
コロンビアで製造された腹膜透析液の特定ロットについて、液漏れが確認されたことから自主回収が行われた。
コロンビア
回収
対応不要
271 アルプラゾラム
パキスタンで、偽造品が発見されたため該当ロットの回収が行われた。
パキスタン
回収
対応不要
273 イトラコナゾール
豪州添付文書が改訂され、Interactions with other medicines and other forms of interactionsの項に以下が追記された。
・イトラコナゾール使用中および使用終了後2週間は、エドキサバン、glasdegib、talazoparibの使用を推奨しない
オーストラリア
・トレチノイン(経口)と併用する際は、抗悪性腫瘍薬の副作用を監視すること、抗悪性腫瘍薬の減量が必要となるかもしれない
・慢性リンパ性白血病/小リンパ球性リンパ腫でベネトクラクス投与開始/用量漸増期の患者は禁忌。それ以外は、イトラコナゾール使用中および使用終了後2
週間は、ベネトクラクスの使用を推奨しない
添付文書改訂(警告・禁忌)
対応済
276 エナラプリルマレイン酸塩
米国FDAは、詳細不明の不純物のため一部のエナラプリル製剤が自主回収されたことを公表した。
回収
対応不要
回収
対応不要
添付文書改訂(警告・禁忌)
注目
スイス
情報提供
注目
オーストラリア
添付文書改訂(警告・禁忌)
対応中
278
レボノルゲストレル・エチニル
エストラジオール
ドイツで、海外企業のレボノルゲストレル・エチニルエストラジオール製剤の特定バッチについて、ブリスターの印刷に誤りがあり、誤った服用順序に導くおそれ
ドイツ
ノルエチステロン・エチニルエ があるため自主回収を行った。
ストラジオール
284 クロルプロマジン塩酸塩
286
アメリカ
豪州添付文書が改訂された。主な改訂箇所は以下のとおり。
・Contraindicationsの項にフェノチアジン系化合物と乳児突然死症候群との関連が示唆されたため、1歳未満の小児が追加された。
・Special warnings and precautions for useの項の自殺、老人、小児、過敏症、肝機能及び腎機能障害患者(投与が推奨されないこと)、離脱症状、糖不耐症
(シロップ剤は糖不耐症患者には推奨されないこと)、無顆粒球症、悪性症候群に関する注意喚起が更新された。
オーストラリア
・Fertility, pregnancy and lactationの項に分娩時(分娩の遅延が生じることがあること)及び新生児における神経障害についての注意喚起が追加された。
・Effects on ability to drive and use machinesの項が更新され、めまい等があらわれることがあるため、本剤の投与開始初期(本剤の影響について明らかに
なるまで)は運転をしないように注意喚起された。
・Adverse effects、Overdoseの項に神経系及び心血管系の事象が追加された。
アテゾリズマブ(遺伝子組換 治験医師宛に情報が発出された。主な内容は以下のとおり。
え)
・免疫関連心膜障害(心膜炎、心嚢液貯留、心タンポナーデ等)が、重要な特定されたリスクに追加された。
豪州添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に「重度の腎機能障害患者、高カルシウム血症の患者、代謝性骨疾患の患者、原因不明のアルカリホスファターゼ上昇を示す患者、
287 テリパラチド(遺伝子組換え) 過去に骨への放射線照射を受けた患者、骨格系悪性腫瘍又は骨転移の患者、妊婦又は授乳婦」が追記された。
・Special warnings and precautions for useの項に中等度腎機能障害患者に対する注意喚起が追記された。
・Adverse Reactionsの項に貧血、腎不全、腎機能障害が追記された。
36