よむ、つかう、まなぶ。
【資料4-1】医薬・生活衛生局からの定期報告 (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
※2
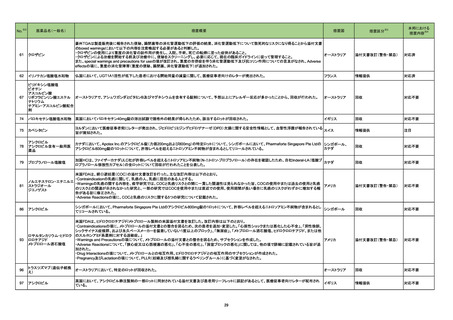
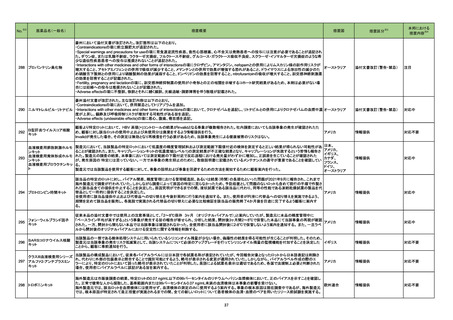
No.
医薬品名(一般名)
措置概要
措置国
※3
措置区分
本邦における
措置内容※4
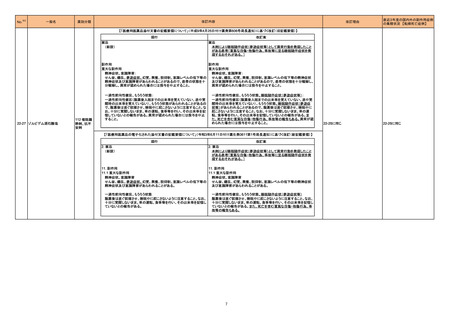
豪州において添付文書が改訂された。改訂箇所は以下のとおり。
・Contraindicationsの項に前立腺肥大が追記された。
・Special warnings and precautions for useの項に胃食道逆流性疾患、急性心筋梗塞、心不全又は発熱患者への投与には注意が必要であることが追記され
た。ダウン症、または乳糖不耐症、ラクターゼ欠損症、フルクトース不耐症、グルコース・ガラクトース吸収不良症、スクラーゼ・イソマルターゼ欠損症のような希
少な遺伝性疾患患者への投与は推奨されないことが追記された。
・Interactions with other medicines and other forms of interactionsの項にクロザピン、アマンタジン、nefopamとの併用によりムスカリン様の副作用リスクが
オーストラリア
増大すること、アセトアミノフェンとの併用で吸収が減少すること、メマンチンとの併用で効果が増強する恐れがあること、ドライマウスによる溶出性の減少のた
め硝酸舌下製剤との併用により硝酸製剤の効果が減弱すること、ドンペリドンの効果を阻害すること、nitrofurantoinの吸収が増大すること、副交感神経刺激薬
の効果を阻害することが記載された。
・Fertility, pregnancy and lactationの項に、副交感神経抑制薬の使用が小奇形との正の相関を示唆するコホート研究結果があるため、本剤は必要がない場
合には妊婦への投与は推奨されないことが記載された。
・Adverse effectsの項に不整脈、徐脈とそれに続く頻脈、光線過敏・調節障害を伴う散瞳が記載された。
添付文書改訂(警告・禁忌)
注目
豪州添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項において、併用禁忌としてトリアゾラムを追加。
290 ニルマトレルビル・リトナビル ・Interactions with other medicines and other forms of interactionsの項において、クロナゼパムを追記し、リトナビルとの併用によりクロナゼパムの血漿中濃 オーストラリア
度が上昇し、鎮静及び呼吸抑制リスクが増加する可能性がある旨を追記。
・Adverse effects (undesirable effects)の項に悪心、腹痛、倦怠感を追記。
添付文書改訂(警告・禁忌)
対応中
288 プロパンテリン臭化物
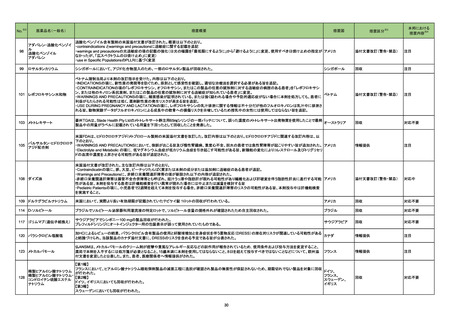
顧客より特定ロットにおいて、 HBV 高値(+)コントロールの結果がInvalidとなる事象が複数報告された。社内調査においても当該事象の発生が確認されたた
め、顧客に対し該当ロットの使用中止および未使用分は廃棄をするよう情報提供を行う。
Invalidが発生した場合、その測定は無効となり再検査を行う必要があるため、当該事象発生による健康被害のリスクはない。
アメリカ
情報提供
対応不要
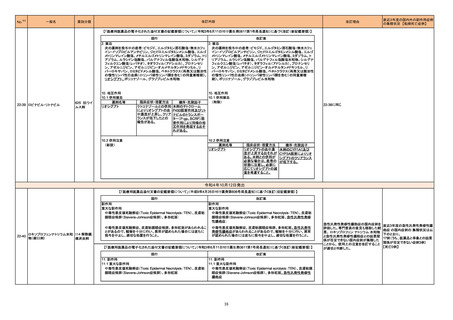
血液検査用卵胞刺激ホルモ
ンキット
血液検査用黄体形成ホルモ
293
ンキット
血液検査用プロラクチンキッ
ト
製造元において、当該製品の特定ロットにおいて低濃度の精度管理試料および測定範囲下限値付近の検体を測定すると正しい結果が得られない可能性があ
ることが確認された。また、キャリブレーションキットの低濃度域(レベル1)の測定結果が不正確な結果となり、キャリブレーションが失敗するという苦情も報告さ
れた。製造元の調査の結果、本事象においては測定範囲の下限付近で反応過程における発光量がわずかに増加し、正誤差を生じていることが確認された
が、発生原因の 特定には至っていない。一方で本事象の発生抑止のために、取扱説明書に記載されているメンテナンスの遵守が重要であることを確認してい
る。
製造元では当該製品を使用する顧客に対して、事象の説明および事象を回避するための方法を周知するために顧客案内を行った。
日本、
アメリカ、
イギリス、
カナダ、
フランス、
ドイツ、
オーストラリア
情報提供
対応中
294 プロトロンビン時間キット
該当品の特定のロットに対し、バイアル間差、精度管理における管理幅逸脱、あるいは結果(時間)の長期化といった問題が2021年9月に報告され、これまで
海外製造元で調査が行われていた。しかしながら調査によって原因の特定に至らなかったため、予防処置として問題のないロットも含めて現行の手順で作製さ
れた該当品全ての提供を中止することを決定した。原因究明ができるまでの間、液状試薬である該当品に代わり、同等の性能である凍結乾燥試薬の製品を代
替品として一時的に提供することを決定した。
アメリカ
全使用者に該当品提供中止および代替品への切り替えを今後計画的に行う案内を通知する。 また、使用者が円滑に代替品への切り替えを実施できるよう、
期間を定めて該当品を販売し、各施設で実施される代替品の切り替えに必要な比較検証を該当品の販売終了4か月後を目途に完了するよう顧客に案内す
る。
情報提供
対応中
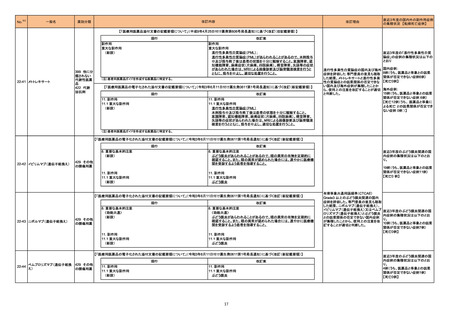
292
B型肝炎ウイルスコア核酸
キット
295
フォン・ウィルブランド因子
キット
従来本品の添付文書中では使用上の注意事項として、「2~8℃保存 3ヶ月 (オリジナルバイアルで)」と案内していたが、製造元に本品の精度管理中に
「ベースライン平均が高すぎる」という事象が発生する旨の報告が寄せられ、分析した結果、開封後3ヶ月間2~8℃で保管した本品にて当該事象の再現が確認
アメリカ
された。一方、開封から間もない本品では当該事象は確認されなかった。全使用者に該当品開封後に2-8℃で保管しないよう案内を通知する。 また、一旦ラベ
ルから開封後のオリジナルバイアルにおける安定性に関する情報を削除する。
情報提供
対応中
296
SARSコロナウイルス核酸
キット
当該製品の一部である検体処理システムに用いられているシリコンオイル残量が少ない場合、偽陽性の結果を得る可能性が生じることが判明した。そのため、
製造元は当該事象の発生リスク低減策として、当該システムについて必須のアップグレードを行ってシリコンオイル残量の監視機能を付加することを決定した イギリス
ことから、顧客に事前通知を行う。
情報提供
対応不要
クラスIII血液検査用シリーズ
297 アルファ2-アンチプラスミン
キット
当該製品の構成製品において、従来各バイアルラベルには日本語で各試薬名称が表記されていたが、今回報告対象となったロットから日本語表記は削除さ
れ、代わりに外部の包装表示と照合することで識別可能とするよう、略号が表示される変更が適用されていた。しかしながら、バイアルラベル作成の際のエ
アメリカ
ラーにより、特定のロットにおいて誤った略号が表示されていたことが判明した。英語による試薬名表示は適切であるため、各国で法規制上必要と判断された
場合、使用者にバイアルラベルに誤記がある旨を案内する。
情報提供
対応不要
298 トロポニンキット
海外製造元は市販後調査の結果、特定ロットの0.07 ng/mL以下の99パーセンタイルのリチウムヘパリン血漿検体において、正のバイアスを示すことを確認し
た。正常で健常な人から採取した、基準範囲内または99パーセンタイル0.07 ng/mL未満の血清検体は本事象の影響を受けない。
欧州連合
海外製造元では、該当ロットを血漿検体には使用せず、血清検体の測定のみに使用するよう案内する。事象の根本原因は現在調査中であるが、海外製造元
では、根本原因が特定されて是正措置が実施されるまでの間、全ての新しいロットについて患者検体の血清・血漿のペアを用いたリリース前試験を実施する。
情報提供
対応不要
37
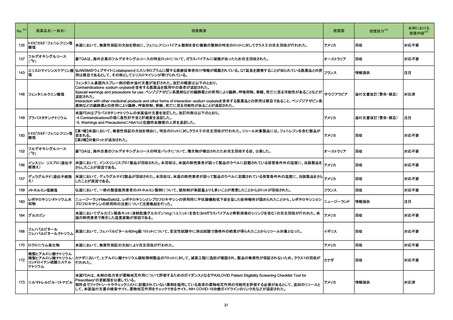
No.
医薬品名(一般名)
措置概要
措置国
※3
措置区分
本邦における
措置内容※4
豪州において添付文書が改訂された。改訂箇所は以下のとおり。
・Contraindicationsの項に前立腺肥大が追記された。
・Special warnings and precautions for useの項に胃食道逆流性疾患、急性心筋梗塞、心不全又は発熱患者への投与には注意が必要であることが追記され
た。ダウン症、または乳糖不耐症、ラクターゼ欠損症、フルクトース不耐症、グルコース・ガラクトース吸収不良症、スクラーゼ・イソマルターゼ欠損症のような希
少な遺伝性疾患患者への投与は推奨されないことが追記された。
・Interactions with other medicines and other forms of interactionsの項にクロザピン、アマンタジン、nefopamとの併用によりムスカリン様の副作用リスクが
オーストラリア
増大すること、アセトアミノフェンとの併用で吸収が減少すること、メマンチンとの併用で効果が増強する恐れがあること、ドライマウスによる溶出性の減少のた
め硝酸舌下製剤との併用により硝酸製剤の効果が減弱すること、ドンペリドンの効果を阻害すること、nitrofurantoinの吸収が増大すること、副交感神経刺激薬
の効果を阻害することが記載された。
・Fertility, pregnancy and lactationの項に、副交感神経抑制薬の使用が小奇形との正の相関を示唆するコホート研究結果があるため、本剤は必要がない場
合には妊婦への投与は推奨されないことが記載された。
・Adverse effectsの項に不整脈、徐脈とそれに続く頻脈、光線過敏・調節障害を伴う散瞳が記載された。
添付文書改訂(警告・禁忌)
注目
豪州添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項において、併用禁忌としてトリアゾラムを追加。
290 ニルマトレルビル・リトナビル ・Interactions with other medicines and other forms of interactionsの項において、クロナゼパムを追記し、リトナビルとの併用によりクロナゼパムの血漿中濃 オーストラリア
度が上昇し、鎮静及び呼吸抑制リスクが増加する可能性がある旨を追記。
・Adverse effects (undesirable effects)の項に悪心、腹痛、倦怠感を追記。
添付文書改訂(警告・禁忌)
対応中
288 プロパンテリン臭化物
顧客より特定ロットにおいて、 HBV 高値(+)コントロールの結果がInvalidとなる事象が複数報告された。社内調査においても当該事象の発生が確認されたた
め、顧客に対し該当ロットの使用中止および未使用分は廃棄をするよう情報提供を行う。
Invalidが発生した場合、その測定は無効となり再検査を行う必要があるため、当該事象発生による健康被害のリスクはない。
アメリカ
情報提供
対応不要
血液検査用卵胞刺激ホルモ
ンキット
血液検査用黄体形成ホルモ
293
ンキット
血液検査用プロラクチンキッ
ト
製造元において、当該製品の特定ロットにおいて低濃度の精度管理試料および測定範囲下限値付近の検体を測定すると正しい結果が得られない可能性があ
ることが確認された。また、キャリブレーションキットの低濃度域(レベル1)の測定結果が不正確な結果となり、キャリブレーションが失敗するという苦情も報告さ
れた。製造元の調査の結果、本事象においては測定範囲の下限付近で反応過程における発光量がわずかに増加し、正誤差を生じていることが確認された
が、発生原因の 特定には至っていない。一方で本事象の発生抑止のために、取扱説明書に記載されているメンテナンスの遵守が重要であることを確認してい
る。
製造元では当該製品を使用する顧客に対して、事象の説明および事象を回避するための方法を周知するために顧客案内を行った。
日本、
アメリカ、
イギリス、
カナダ、
フランス、
ドイツ、
オーストラリア
情報提供
対応中
294 プロトロンビン時間キット
該当品の特定のロットに対し、バイアル間差、精度管理における管理幅逸脱、あるいは結果(時間)の長期化といった問題が2021年9月に報告され、これまで
海外製造元で調査が行われていた。しかしながら調査によって原因の特定に至らなかったため、予防処置として問題のないロットも含めて現行の手順で作製さ
れた該当品全ての提供を中止することを決定した。原因究明ができるまでの間、液状試薬である該当品に代わり、同等の性能である凍結乾燥試薬の製品を代
替品として一時的に提供することを決定した。
アメリカ
全使用者に該当品提供中止および代替品への切り替えを今後計画的に行う案内を通知する。 また、使用者が円滑に代替品への切り替えを実施できるよう、
期間を定めて該当品を販売し、各施設で実施される代替品の切り替えに必要な比較検証を該当品の販売終了4か月後を目途に完了するよう顧客に案内す
る。
情報提供
対応中
292
B型肝炎ウイルスコア核酸
キット
295
フォン・ウィルブランド因子
キット
従来本品の添付文書中では使用上の注意事項として、「2~8℃保存 3ヶ月 (オリジナルバイアルで)」と案内していたが、製造元に本品の精度管理中に
「ベースライン平均が高すぎる」という事象が発生する旨の報告が寄せられ、分析した結果、開封後3ヶ月間2~8℃で保管した本品にて当該事象の再現が確認
アメリカ
された。一方、開封から間もない本品では当該事象は確認されなかった。全使用者に該当品開封後に2-8℃で保管しないよう案内を通知する。 また、一旦ラベ
ルから開封後のオリジナルバイアルにおける安定性に関する情報を削除する。
情報提供
対応中
296
SARSコロナウイルス核酸
キット
当該製品の一部である検体処理システムに用いられているシリコンオイル残量が少ない場合、偽陽性の結果を得る可能性が生じることが判明した。そのため、
製造元は当該事象の発生リスク低減策として、当該システムについて必須のアップグレードを行ってシリコンオイル残量の監視機能を付加することを決定した イギリス
ことから、顧客に事前通知を行う。
情報提供
対応不要
クラスIII血液検査用シリーズ
297 アルファ2-アンチプラスミン
キット
当該製品の構成製品において、従来各バイアルラベルには日本語で各試薬名称が表記されていたが、今回報告対象となったロットから日本語表記は削除さ
れ、代わりに外部の包装表示と照合することで識別可能とするよう、略号が表示される変更が適用されていた。しかしながら、バイアルラベル作成の際のエ
アメリカ
ラーにより、特定のロットにおいて誤った略号が表示されていたことが判明した。英語による試薬名表示は適切であるため、各国で法規制上必要と判断された
場合、使用者にバイアルラベルに誤記がある旨を案内する。
情報提供
対応不要
298 トロポニンキット
海外製造元は市販後調査の結果、特定ロットの0.07 ng/mL以下の99パーセンタイルのリチウムヘパリン血漿検体において、正のバイアスを示すことを確認し
た。正常で健常な人から採取した、基準範囲内または99パーセンタイル0.07 ng/mL未満の血清検体は本事象の影響を受けない。
欧州連合
海外製造元では、該当ロットを血漿検体には使用せず、血清検体の測定のみに使用するよう案内する。事象の根本原因は現在調査中であるが、海外製造元
では、根本原因が特定されて是正措置が実施されるまでの間、全ての新しいロットについて患者検体の血清・血漿のペアを用いたリリース前試験を実施する。
情報提供
対応不要
37