【資料2】新型コロナウイルス感染症治療薬(ゾコーバ錠125mg)について(医薬・生活衛生局からの説明資料) (103 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
副作用
全
重篤な
体
有害事象
死亡に至った
有害事象
投与中止に至
った有害事象
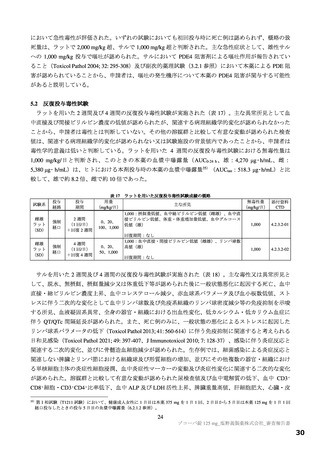
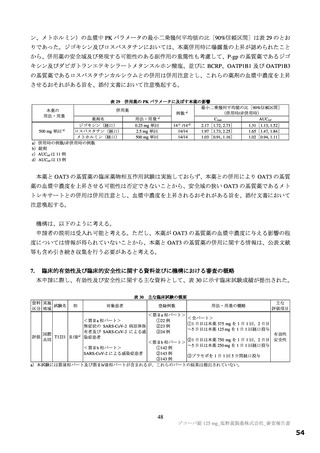
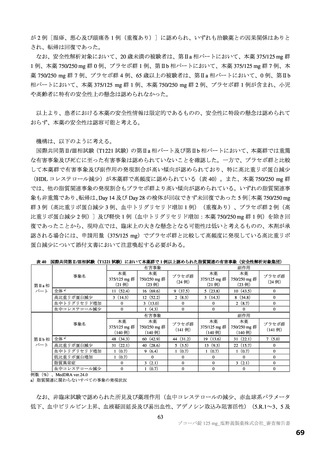
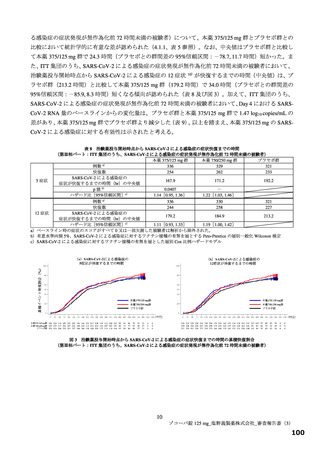
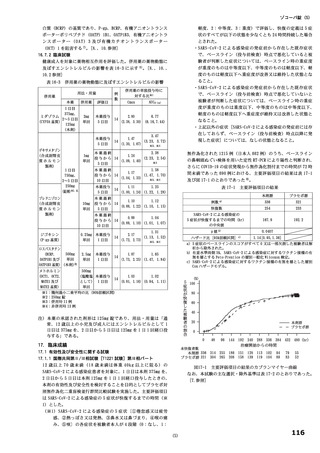
表 11 国際共同第Ⅱ/Ⅲ相試験(T1221 試験)における安全性の概要(安全性解析対象集団)
第Ⅱa 相パート a)
第Ⅱb 相パート
第Ⅲ相パート
本薬
本薬
本薬
本薬
本薬
本薬
プラセボ群
プラセボ群
プラセボ群
375/125 mg 群 750/250 mg 群
375/125 mg 群 750/250 mg 群
375/125 mg 群 750/250 mg 群
(24 例)
(141 例)
(605 例)
(21 例)
(23 例)
(140 例) (140 例)
(604 例) (599 例)
11(52.4) 16(69.6) 9(37.5) 48(34.3) 60(42.9) 44(31.2) 267(44.2) 321(53.6) 150(24.8)
5(23.8)
10(43.5)
0
19(13.6) 31(22.1) 7(5.0) 148(24.5) 217(36.2) 60(9.9)
0
0
0
0
0
2(1.4)
1(0.2)
0
1(0.2)
0
0
0
0
0
0
0
0
0
0
0
0
2(1.4)
0
0
4(0.7)
6(1.0)
2(0.3)
本薬
本薬
本薬
本薬
本薬
本薬
プラセボ群
プラセボ群
プラセボ群
375/125 mg 群 750/250 mg 群
375/125 mg 群 750/250 mg 群
375/125 mg 群 750/250 mg 群
(24 例)
(138 例)
(320 例)
(21 例)
(23 例)
(138 例) (137 例)
(339 例) (311 例)
11(52.4) 16(69.6) 9(37.5) 48(34.8) 59(43.1) 44(31.9) 179(52.8) 201(64.6) 81(25.3)
5(23.8)
10(43.5)
19(13.8) 30(21.9) 7(5.1) 81(23.9) 120(38.6) 16(5.0)
0
日
本
人
部
分
集
団
有害事象
副作用
重篤な
2(1.4)
1(0.3)
0
0
0
0
0
有害事象
死亡に至った
0
0
0
0
0
0
0
有害事象
投与中止に至
2(1.4)
3(0.9)
0
0
0
0
0
った有害事象
例数(%)
a)第Ⅱa 相パートは本邦で実施されたため、全体集団と日本人部分集団での各事象の数値は同一である。
0
0
0
0
5(1.6)
1(0.3)
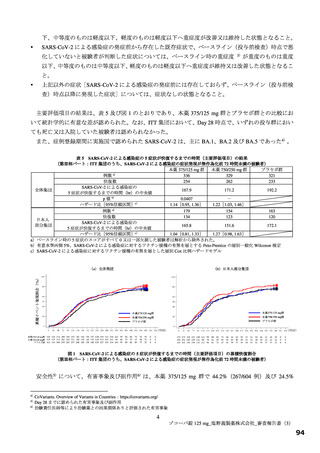
いずれのパートにおいても、有害事象及び副作用の発現割合は、プラセボ群より本薬群で高い傾向が認
められ、また、本薬 375/125 mg 群より本薬 750/250 mg 群で高かった。
重篤な有害事象は、第Ⅲ相パートの本薬 375/125 mg 群 1 例(重度月経出血)に認められ、治験薬との
因果関係は否定され、転帰は回復であった。死亡に至った有害事象は、いずれのパートにおいても認めら
れなかった。投与中止に至った有害事象は、第Ⅱb 相パートの本薬 375/125 mg 群 2 例[湿疹、悪心及び頭
痛各 1 例(重複あり)]、第Ⅲ相パートの本薬 375/125 mg 群 4 例(湿疹、嘔吐、発疹及び高血圧各 1 例)、
本薬 750/250 mg 群 6 例[発疹 2 例、悪心、頭痛、腹痛、失神寸前の状態及び嘔吐各 1 例(重複あり)]
に認められた。このうち、第Ⅱb 相パートの本薬 375/125 mg 群 2 例[湿疹、悪心及び頭痛各 1 例(重複あ
り)]及び第Ⅲ相パートの本薬 375/125 mg 群 2 例(湿疹及び嘔吐各 1 例)、本薬 750/250 mg 群 2 例(発
疹 2 例)は治験薬との因果関係がありとされ、転帰は回復又は軽快であった。
なお、安全性解析対象集団において、18 歳未満の被験者は、本薬 375/125 mg 群 11 例、本薬 750/250 mg
群 16 例、プラセボ群 22 例が含まれ、本薬群において、18 歳未満のみで認められた有害事象や重篤な有
害事象、死亡に至った有害事象及び投与中止に至った有害事象は認められなかった。
また、日本人における安全性について、第Ⅱa 相パートはすべての被験者が日本人、第Ⅱb 相パートは
98.1%(413/421 例)の被験者が日本人であったため、第Ⅲ相パートの結果を用いて検討したところ、本薬
群の有害事象の発現割合が全体集団と比較して日本人部分集団で高い傾向が認められたが、副作用、重篤
な有害事象及び投与中止に至った有害事象の発現割合は全体集団と日本人部分集団で大きく異ならなか
った。
なお、第Ⅱb 相パートのデータベースロック後に、本薬 750/250 mg 群 1 例(頚部痛)及びプラセボ群 2
例(血中クレアチンホスホキナーゼ増加及び胸部不快感各 1 例)の有害事象の EDC への入力漏れが確認
されたが、いずれも非重篤であり、治験薬との因果関係は否定されたことから、本薬の安全性評価に大き
く影響するものではないと判断した。
以上より、安全性に特段の懸念は認められておらず、本薬の安全性は忍容可能と考える。
13
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書(3)
103