【資料2】新型コロナウイルス感染症治療薬(ゾコーバ錠125mg)について(医薬・生活衛生局からの説明資料) (104 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
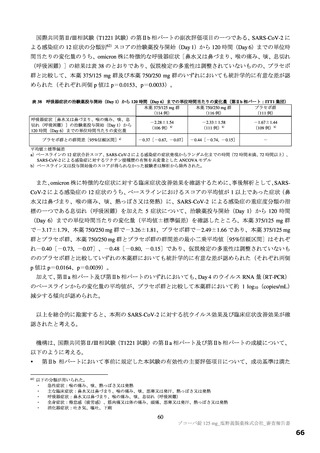
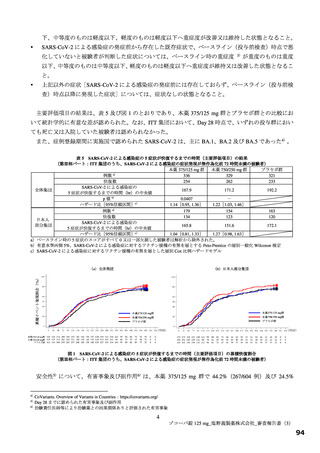
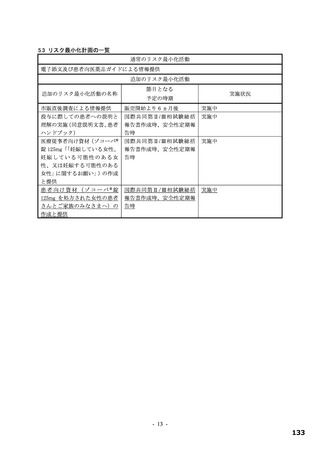
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)において、プラセボ群と比較して本薬群で有害事象及び副作用の
発現割合が高い傾向が認められており、特に高比重リポ蛋白減少(HDL コレステロール減少)が本薬群
で高頻度に認められている(表 12)。高比重リポ蛋白減少を含めた脂質関連事象の発現状況は表 12 のと
おりであり、いずれも非重篤であり、臨床上の大きな懸念となる可能性は低いと考えるものの、発現状況
を踏まえ、高比重リポ蛋白減少について添付文書において注意喚起する必要がある。
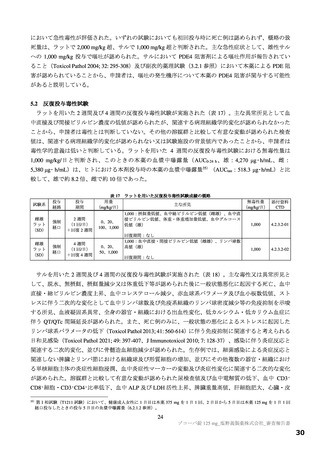
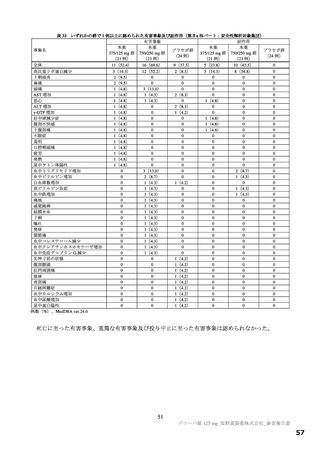
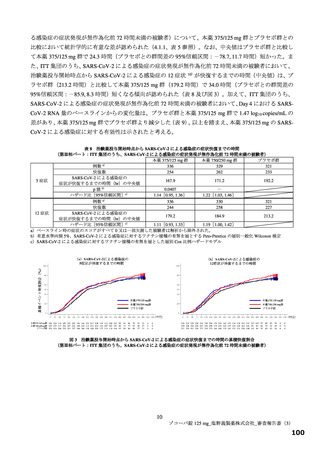
表 12 国際共同第Ⅱ/Ⅲ相試験(T1221 試験)a)において本薬群で 1 例以上認められた脂質関連の有害事象(安全性解析対象集団)
有害事象
副作用
本薬
本薬
本薬
本薬
事象名
プラセボ群
プラセボ群
375/125 mg 群 750/250 mg 群
375/125 mg 群 750/250 mg 群
(766 例)
(766 例)
(763 例)
(759 例)
(763 例)
(759 例)
b)
全体
325(42.6)
395(52.0)
205(26.8)
172(22.5)
255(33.6)
67(8.7)
高比重リポ蛋白減少
222(29.1)
281(37.0)
30(3.9)
127(16.6)
185(24.4)
9(1.2)
血中トリグリセリド増加
50(6.6)
85(11.2)
33(4.3)
17(2.2)
39(5.1)
17(2.2)
血中コレステロール減少
20(2.6)
30(4.0)
3(0.4)
8(1.0)
12(1.6)
1(0.1)
低比重リポ蛋白増加
6(0.8)
3(0.4)
4(0.5)
2(0.3)
1(0.1)
3(0.4)
脂質異常症
2(0.3)
3(0.4)
1(0.1)
2(0.3)
3(0.4)
0
血中コレステロール増加
2(0.3)
2(0.3)
3(0.4)
1(0.1)
0
0
高トリグリセリド血症
2(0.3)
2(0.3)
2(0.3)
1(0.1)
2(0.3)
1(0.1)
低比重リポ蛋白減少
0
1(0.1)
2(0.3)
0
1(0.1)
2(0.3)
血中トリグリセリド減少
1(0.1)
1(0.1)
0
0
0
0
例数(%)、MedDRA ver.24.0
a)第Ⅱa 相、第Ⅱb 相及び第Ⅲ相パートの併合。なお、第Ⅱa 相パートの安全性解析対象集団のうち、SARS-CoV-2 による感染症の症状が
ない被験者 9 例[本薬 375/125 mg 群 2 例、750/250 mg 群 3 例及びプラセボ群 4 例]は当該解析から除外されたが、本薬 750/250 mg 群
2 例に脂質関連有害事象[高比重リポ蛋白減少 2 例、血中トリグリセリド増加 1 例(重複あり)]が認められた。
b)脂質関連に関わらないすべての事象の発現状況
なお、非臨床試験で認められた所見及び薬理作用(血中コレステロールの減少、赤血球系パラメータ低
下、血中ビリルビン上昇、血液凝固延長及び易出血性、アデノシン取込み阻害活性)[審査報告(1)5.R.1
~3、5 及び 3.R.3 参照]について、直ちに安全性上の懸念となるような重篤な有害事象の発現は認められ
ていないことを確認した。
以上の検討及び国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の有害事象の発現状況を踏まえると、SARS-CoV2 による感染症の患者における本薬の安全性に大きな懸念は認められておらず、全体集団及び日本人部分
集団で発現割合の高い主な有害事象は高比重リポ蛋白減少であったことから、忍容性は許容可能と考え
る。また、本試験から得られた情報を踏まえて適切に添付文書において注意喚起を行うとともに、以下の
点について対応することで本剤の安全性リスクは管理可能と考える。ただし、小児患者における本薬の投
与経験は限られており、特に体重 40 kg 未満の小児における投与経験はないことから、製造販売後におい
ても引き続き情報収集を行い、新たな知見が得られた場合には適切に医療現場に情報提供する必要があ
る。
非臨床試験において胎児に奇形を示唆する所見が認められており、本薬は潜在的な催奇形性リスクを
有すること等を踏まえ、妊婦又は妊娠している可能性のある女性に対する本剤の投与は禁忌とする
[審査報告(1)5.R.6 参照]。
本薬は CYP3A の阻害作用を有する等、他の薬剤との相互作用が生じる可能性があることから、適切
に注意喚起を行う[審査報告(1)6.R.6 及び審査報告書(2)1.R 参照]。
以上の機構の判断については、専門協議で議論する。
14
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書(3)
104