【資料2】新型コロナウイルス感染症治療薬(ゾコーバ錠125mg)について(医薬・生活衛生局からの説明資料) (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
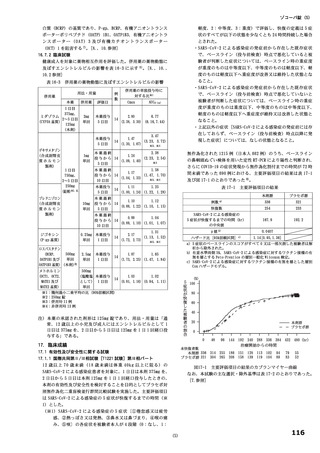
原薬は出発物質A*
出発物質B* 及び
出発物質C* を出発物質として合成される。
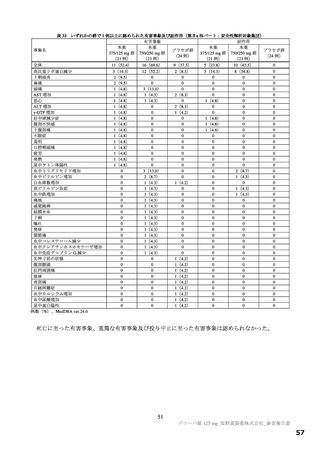
以下の検討等により、品質の管理戦略が構築されている (表1) 。
* COAの特定
* 品質リスクアセスメントに基づく重要工程パラメータの特定
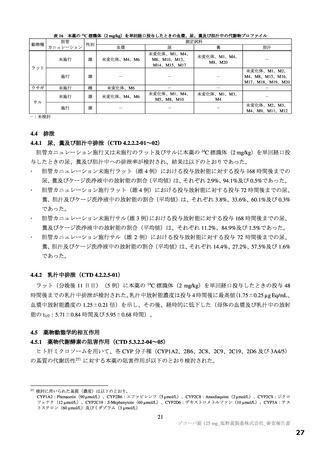
表1 原薬の管理戦略の概要
COA" 管理方法
含量 規格及び試験方法
性状 製造方法、規格及び試験方法
同一性 製造方法、規格及び試験方法
類縁物質 製造方法、規格及び試験方法
還還還還還還較 製造方法、規格及び試験方法
残留溶媒 製造方法、規格及び試験方法
画題是較 規格及び試験方法
強熱残分 規格及び試験方法
水分 規格及び試験方法
s) 半軒還畔較について、原薬に対するリスクアセスメントの結果、
還還町還還較を直えて残留する可能性はないと判断され、CQOA に設定されていない。
重要工程として、 中間体である中間体D?? 合成工程、 中間体E* 合成工程及び証議
工程が設定されている。 また、 重要中間体として、中間体D*及び中間体E* が管理さ
れている。
2.1.3 原薬の管理
原薬の規格及び試験方法として、 含量 (エンシトレルビル及びフマル酸) 、性状、確認試験 (赤外吸
収スペクトル及び液体クロマトグラフィー) 、純度試験 [類縁物質 (液体クロマトグラフィー) 、頻縁物質F*)
(還還還還還還還還還還是是是是症較) 、残凡溶泡 (がスクロマトグラフィー) ] 、水分、強熱残分及
び定量法 [エンシトレルビル (液体クロマトグラフィー) 、フマル酸 (液体クロマトグラフィー) ] が
設定されている。
なお、審査の過程において、フマル酸は純度試験から定量法に変更され、含量に追加された。
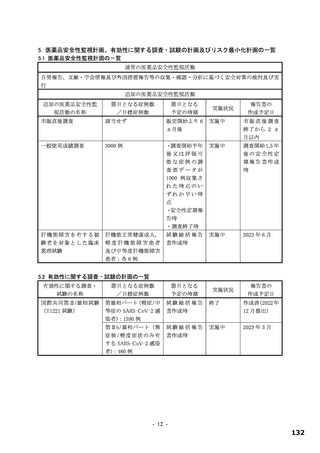
2.1.4 原薬の安定性
原薬で実施された主な安定性試験は表 2 のとおりであり、結果は安定であった。また、光安定性試験
の結果、原薬は光に安定であった。
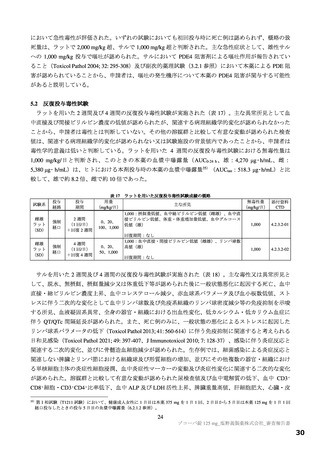
表2 原薬の安定性試験
試験名 基準ロット 温度 湿度 保存形態 保存期間
パイロットスケール 9
長期保存試験 3ロット | | 低鶴度ポリエチレン袋 (二重) 3
加速試験 間 コロコット 40C | 759sRE +ファイバードラム 3 カ月"
a) パイロットスケールル3ロットのうち、2 ロットが6カカ月目まで、1ロットが3ぅカカ月目までのデータが提出された。
う 中間体D*
3 変異原性不純物 (タラス 2) に対する管理として、原薬での規格及び試験方法が設定されている。
3
ゾコーバ錠 125 mg 塩野義製薬株式会社 審査報告書
*新楽承認情報提供時に思換