【資料2】新型コロナウイルス感染症治療薬(ゾコーバ錠125mg)について(医薬・生活衛生局からの説明資料) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2)」(令和 3 年 6 月 17 日付け薬生薬審 0617 第 9 号、薬生機審発 0617 第 1 号)に基
づく優先審査
[審査担当部]
新薬審査第四部
[審 査 結 果]
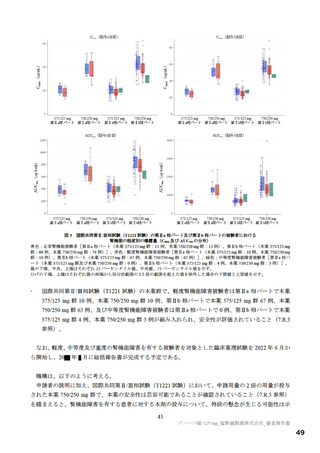
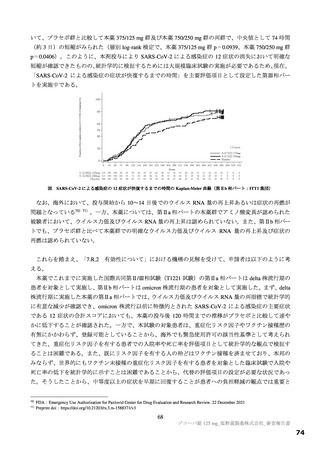
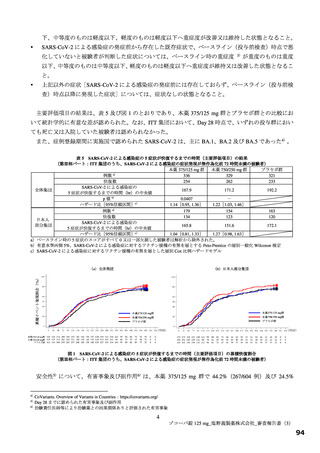
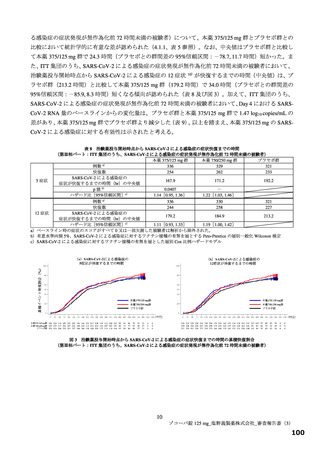
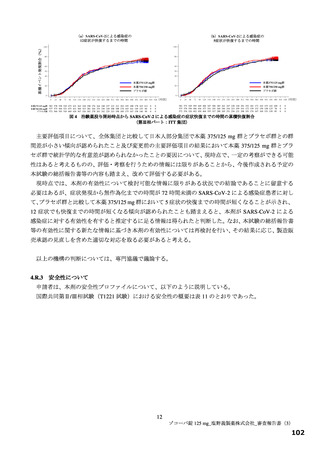
別紙のとおり、提出された資料から、本品目の SARS-CoV-2 による感染症に対する有効性について、
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱa 相パート及び第Ⅱb 相パートの成績に基づき、本薬により
ウイルス量が減少する傾向が認められていることは否定しないが、申請効能・効果に対する有効性が推
定できるものとは判断できず、当該試験の第Ⅲ相パートの結果等を踏まえて改めて検討する必要がある
と考える。有効性の評価は上記のとおりであるものの、医療・社会的観点から、本剤をより早期に使用
可能とすることの検討も可能と考える。ただし、現時点で得られている情報等を踏まえて本剤が承認さ
れる場合には、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅲ相パートの成績等に基づき有効性を再検討
し、その結果に応じ、製造販売承認の見直しを含めた適切な対応を取る必要があると考える。
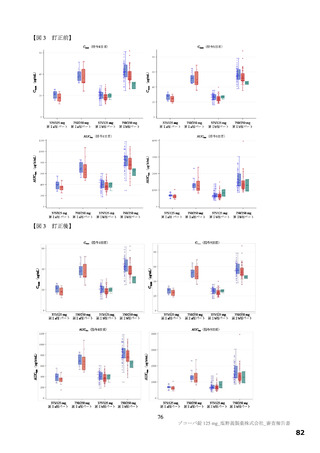
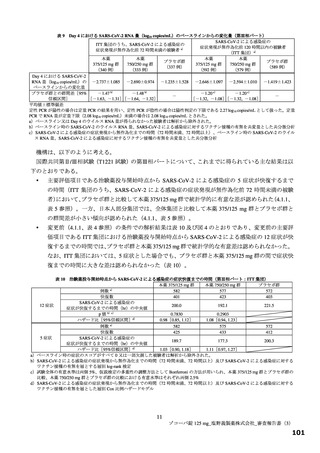
本薬の安全性について、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱa 相及び第Ⅱb 相パートの結果を
踏まえると、安全性上の大きな懸念は認められず、一定の忍容性は示されていると考えるが、SARS-CoV2 による感染症の患者に対する本薬の投与経験は限られており、本剤が製造販売後に多くの患者に使用
された場合に、新たな安全性上の懸念が生じる可能性は否定できないと考える。なお、現時点で得られ
ている情報等を踏まえて、本剤が承認される場合には、添付文書において、催奇形性リスク及び薬物相
互作用を含めて適切に注意喚起を行う必要がある。また、実施中の国際共同第Ⅱ/Ⅲ相試験(T1221 試験)
の第Ⅱb/Ⅲ相及び第Ⅲ相パートの情報を含め、さらに安全性の検討を行い、新たな知見が得られた場合
には適切に医療現場に情報提供する必要があると考える。
[効能又は効果]
SARS-CoV-2 による感染症
[用法及び用量]
通常、12 歳以上の小児及び成人にはエンシトレルビルとして 1 日目は 375 mg を、2 日目から 5 日目
は 125 mg を 1 日 1 回経口投与する。
[承 認 条 件]
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
2. 本剤の投与が適切と判断される症例のみを対象に、あらかじめ患者又は代諾者に有効性及び安全
性に関する情報が文書をもって説明され、文書による同意を得てから初めて投与されるよう、医
師に対して要請すること。
3. 国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅲ相パートについて、終了後速やかに試験成績を提出
すること。
2
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
6