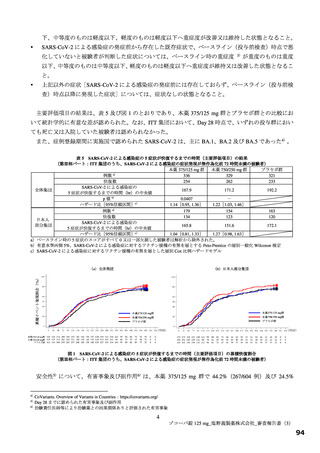
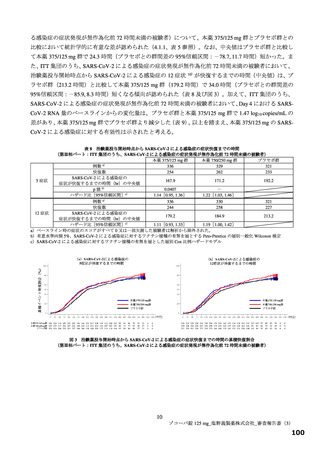
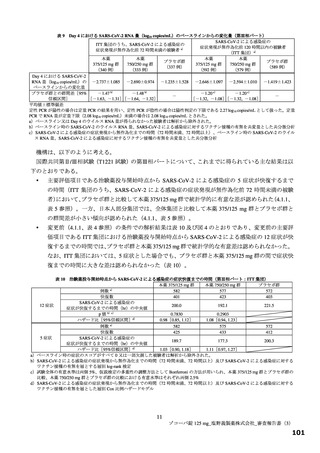
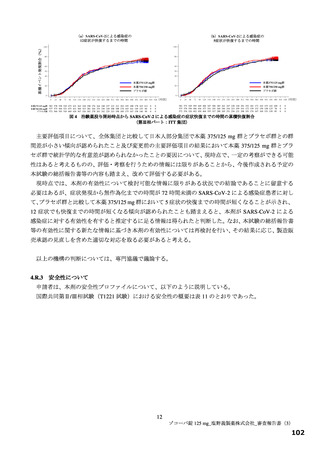
【資料2】新型コロナウイルス感染症治療薬(ゾコーバ錠125mg)について(医薬・生活衛生局からの説明資料) (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
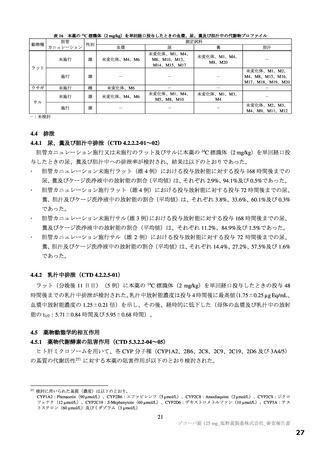
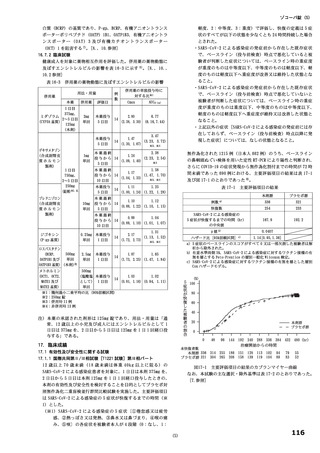
用量
無毒性量 添付資料
主な所見
(mg/kg/日)
(mg/kg/日) CTD
全身毒性評価
≧10:血中 HDL・LDL・総コレステロール低値(雌雄)
30:血中総・直接ビリルビン高値、肝臓重量高値、副腎束状帯脂肪滴減少
(雌雄)、体重・摂餌量低値、QT/QTc 間隔延長、尿 pH 低値、尿ケトン
体・ビリルビン・ウロビリノーゲン・タンパク・グルコース・白血球数高
値、赤血球数・ヘモグロビン・ヘマトクリット低値、網状赤血球比率/数・
リンパ球数・好中球数・単球数・好塩基球数・フィブリノーゲン高値、血
中 ALP・LDH・トリグリセリド・フェリチン・C 反応性タンパク高値、血
中アルブミン・A/G 比・グルコース・カルシウム・ナトリウム・クロール
4 週間
低値、心嚢水貯留、脾臓重量高値、骨髄造血細胞増加、胆嚢筋層炎症性細
雌雄
(1 回/日)
強制
胞浸潤、心膜・大腸・皮膚/皮下組織・膀胱脂肪組織壊死/肉芽腫性炎、
10
4.2.3.2-04
カニクイ
0、3、10、30
経口
肝臓クッパー細胞赤血球貪食・髄外造血亢進・肝細胞肥大・門脈単核細胞
+回復
ザル
浸潤・門脈周囲肝細胞空胞化、顎下リンパ節リンパ球減少、膵臓腺房拡
4 週間
張・分泌低下、耳下腺分泌減少、脾臓うっ血・髄外造血亢進、子宮筋層血
管周囲単核細胞浸潤(雌)
投与
試験系
経路
投与
期間
免疫毒性評価
30:血中 CD3+CD8+細胞比率低値(雌雄)、血中 CD3+CD8+細胞数低値
(雄)、血中 CD3+細胞比率・CD3+CD4+細胞比率・CD3−CD20+細胞比率
低値(雌)
回復性あり
5.3
遺伝毒性試験
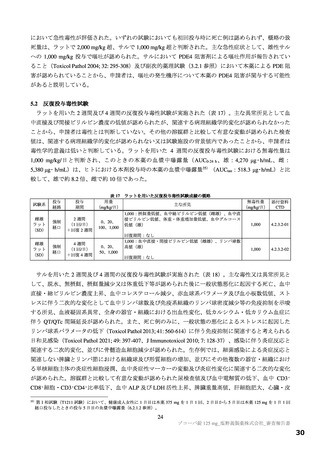
細菌を用いた復帰突然変異試験(Ames 試験)、ヒトリンパ芽球由来 TK6 細胞を用いた in vitro 小核試
験、ラットを用いた小核試験が実施された(表 19)。いずれの試験においても結果が陰性であったこと
から、申請者は本薬は遺伝毒性を有しないと判断している。
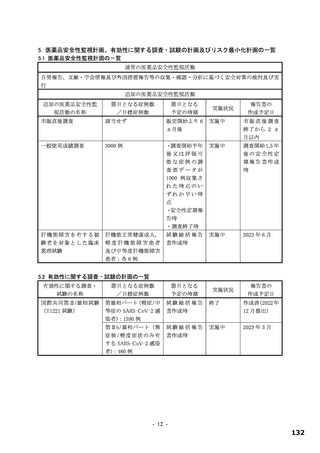
表 19
試験の種類
Ames 試験
in vitro
小核試験
in vivo
ラット
小核試験
遺伝毒性試験成績の概略
代謝活性化
添付資料
試験系
濃度又は用量
試験成績
CTD
(処置)
ネズミチフス菌:TA98、TA100、
0 a)、156、313、625、1,250、2,500、
TA1535
5,000 µg/plate
大腸菌:WP2uvrA
4.2.3.3-01
S9-/+
陰性
0 a)、39.1、78.1、156、313、625、1,250、
ネズミチフス菌:TA1537
2,500、5,000 µg/plate
S9-/+
0 a)、150、200、250 µg/mL
(3 時間)
4.2.3.3-03
ヒトリンパ芽球由来 TK6 細胞
陰性
S9-
0 a)、75、100、125 µg/mL
(24 時間)
0、500、1,000、2,000 mg/kg/日
4.2.3.3-05
雄ラット(SD)骨髄細胞
陰性
(強制経口、3 日間)
a)溶媒:DMSO
5.4
がん原性試験
本剤の投与期間は通常 5 日間であること及び遺伝毒性を有しないことから(5.3 参照)、がん原性試験
は実施されていない。
5.5
生殖発生毒性試験
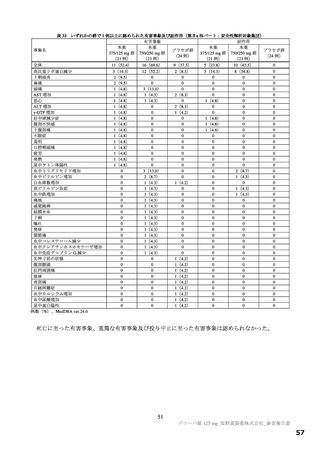
ラットを用いた受胎能及び着床までの初期胚発生に関する試験、ラット及びウサギを用いた胚・胎児
発生に関する試験、ラットを用いた出生前及び出生後の発生並びに母体の機能に関する試験が実施され
た(表 20)。主な毒性所見として、ラットにおいて胎児の骨格変異及びウサギにおいて胚・胎児死亡、
胎児の軸骨格に奇形・変異、外表に奇形所見として短尾及び二分脊椎が認められた。ラットの出生児に
27
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
33