【資料2】新型コロナウイルス感染症治療薬(ゾコーバ錠125mg)について(医薬・生活衛生局からの説明資料) (106 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
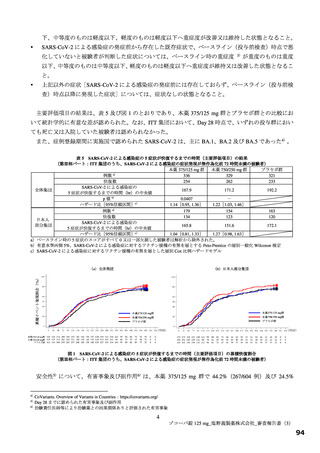
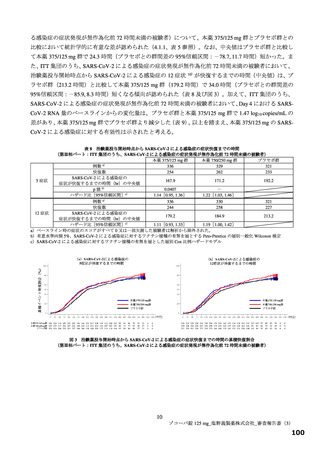
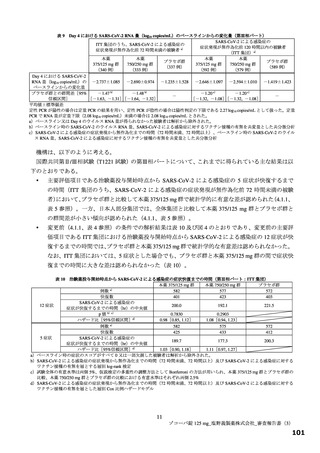
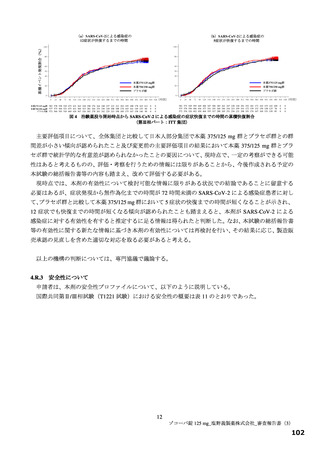
効性を有すると推定するに足る情報は得られたと判断した。なお、本試験の総括報告書等の有効性に関す
る新たな情報に基づき有効性を再検討し、その結果に応じ、製造販売承認の見直しを含めた適切な対応を
取る必要があると考える。
安全性について、催奇形性リスク及び薬物相互作用を含めて適切に注意喚起を行うことで本剤の安全
性リスクは管理可能と考える。ただし、小児患者における本薬の投与経験は限られており、特に体重 40 kg
未満の小児における投与経験はないことから、製造販売後においても引き続き情報収集を行い、新たな知
見が得られた場合には適切に医療現場に情報提供する必要がある。
6.
その他
6.1 国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅲ相パートの試験中の主な試験計画の変更内容について
本試験の第Ⅲ相パートの試験中に行われた主な試験計画の変更内容は以下のとおりである。
プロトコル第 7 版(2022 年 2 月 7 日改訂)
有効性の検証対象の用量
本薬 375/125 mg 及び本薬 750/250 mg
主要評価項目
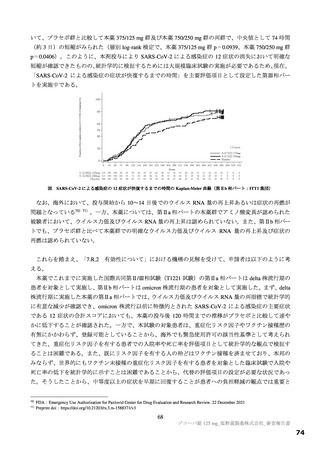
治験薬投与開始時点から SARS-CoV-2 による感染症の 12 症状 a)が回復 b)するまでの時間
ITT2 集団(無作為化され、かつ Visit 1(投与前)と Visit 2 のいずれかで鼻咽頭ぬぐい検体で RT-PCR が
有効性の主要な解析対象集団
陽性)のうち中等度の症状が 3 個以上の集団
必要被験者数
1,260 例(各群 420 例)
症状が回復するまでの時間の中央値としてプラセボ群は 7 日、各本薬群は共に 5.5 日と仮定し(プラセボ
群に対するハザード比として 1.27 を仮定)、有意水準両側 2.5%の下、log-rank 検定で検出力 80%を確保
被験者数の設定根拠
するために必要な被験者数として、登録直前の検査における RT-PCR 陰性による脱落率を約 10%と想定
し、中等度の症状が 3 個以上の SARS-CoV-2 感染症患者の 3 群合計で 1,128 例(各群 376 例)と算出さ
れた。
主要評価項目の解析方法
層別 log-rank 検定
Bonferroni の方法が用いられ、主要評価項目の解析の各本薬群とプラセボ群の比較における有意水準はそ
仮説検定の多重性の調整方法
れぞれ両側 2.5%
目標被験者数に対する 50%の症例数で追跡が完了した時点において早期有効中止を目的とした中間解析
中間解析
を実施。中間解析における仮説検定の多重性の調整方法として O’Brien–Fleming 型の α 消費関数
プロトコル第 8 版(2022 年 4 月 5 日改訂)
有効性の検証対象の用量
本薬 375/125 mg 及び本薬 750/250 mg
主要評価項目
治験薬投与開始時点から SARS-CoV-2 による感染症の 12 症状 a)が快復 c)するまでの時間
ITT1 集団(無作為化され、かつベースラインの鼻咽頭ぬぐい検体において SARS-CoV-2 のウイルス力価
有効性の主要な解析対象集団
が検出された被験者)
必要被験者数
1,785 例(各群 595 例)
症状が快復するまでの時間の中央値としてプラセボ群は 10 日、各本薬群は共に 8 日と仮定し(プラセボ
群に対するハザード比として 1.25 を仮定)、有意水準両側 2.5%の下、log-rank 検定で検出力 80%を確保
被験者数の設定根拠
するために必要な被験者数として、Visit 1(投与前)での SARS-CoV-2 のウイルス力価未検出による脱落
を 20%と想定し、SARS-CoV-2 感染症患者の 3 群合計で 1,785 例(各群 595 例)と算出された。
主要評価項目の解析方法
層別 log-rank 検定
Bonferroni の方法が用いられ、主要評価項目の解析の各本薬群とプラセボ群の比較における有意水準はそ
仮説検定の多重性の調整方法
れぞれ両側 2.5%
症例登録状況から、中間解析よりも前に目標被験者数(1,785 例)の登録が完了すると予想されたことか
中間解析
ら、中間解析に関する記載が削除された。
プロトコル第 9 版(2022 年 7 月 8 日改訂)
有効性の検証対象の用量
本薬 375/125 mg 及び本薬 750/250 mg
主要評価項目
治験薬投与開始時点から SARS-CoV-2 による感染症の 12 症状 a)が快復 c)するまでの時間
有効性の主要な解析対象集団 ITT 集団
必要被験者数
1,590 例(各群 530 例)
症状が快復するまでの時間の中央値としてプラセボ群は 10 日、各本薬群は共に 8 日と仮定し(プラセボ
群に対するハザード比として 1.25 を仮定)、有意水準両側 2.5%の下、log-rank 検定で検出力 80%を確保
被験者数の設定根拠
するために必要な被験者数として、登録直前の検査における RT-PCR 陰性による脱落を 10%と想定し、
SARS-CoV-2 感染症患者の 3 群合計で 1,590 例(各群 530 例)と算出された。
主要評価項目の解析方法
層別 log-rank 検定
Bonferroni の方法が用いられ、主要評価項目の解析の各本薬群とプラセボ群の比較における有意水準はそ
仮説検定の多重性の調整方法
れぞれ両側 2.5%
プロトコル第 10 版(2022 年 9 月 20 日改訂)
有効性の検証対象の用量
本薬 375/125 mg
主要評価項目
治験薬投与開始時点から SARS-CoV-2 による感染症の 5 症状 d)が快復 c)するまでの時間
16
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書(3)
106